题目内容
【题目】I、为测定金属钠样品(表面有 Na2O)的钠单质的质量分数,设计了如下实验(反应装置如右图所示):
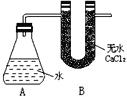
①称量 A、B的总质量 ②称取一定质量的钠样品 ③将钠样品投入锥形瓶中,迅速塞紧带U形干燥管的橡皮塞
有关数据是:称取的金属钠样品质量为a g, A、B反应前总质量为b g,反应后A、B的总质量为c g。
请根据题意回答下列问题:
(1)钠与水反应的离子方程式为________________________________。
(2)用 a、b、c表示的钠单质的质量分数为________________________________。
(3)没有B装置对实验结果有何影响________(填“偏大”或“偏小”“不影响”)?
Ⅱ、现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下图。回答下列问题(注:Na2O2可以与H2O、CO2反应):
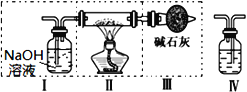
(1)上述装置Ⅳ中盛放的试剂是___________,为完成实验应将装置Ⅳ接在______(选填)。
A.Ⅰ之前 B. Ⅰ和Ⅱ之间 C. Ⅱ和Ⅲ之间 D. Ⅲ之后
(2)装置Ⅲ的作用 ________________________________________________________。
(3)为制得更纯的Na2O2,应______(填“先”或“后”,下同)通空气______点燃酒精灯。
(4)点燃酒精灯后,观察到装置 II 中的现象为 _______________________________。
【答案】 2Na+2H2O =2Na++2OH-+H2↑ 23(a+b-c)/a 偏大 浓硫酸 B 防止空气中的水蒸气和二氧化碳进入Ⅱ中 先 后 钠熔化成光亮的小球,剧烈燃烧产生黄色火焰,生成淡黄色固体
【解析】I、(1)钠与水反应生成氢氧化钠和氢气,反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑。(2)A、B反应前减少的质量就是反应中生成的氢气质量,为(a+b-c)g,氢气的物质的量是![]() ,根据方程式可知金属钠的质量是
,根据方程式可知金属钠的质量是![]() ,所以用a、b、c表示的钠单质的质量分数为
,所以用a、b、c表示的钠单质的质量分数为![]() ;(3)没有B装置,氢气会带出水蒸气,导致氢气的质量增加,所以结果会偏大;
;(3)没有B装置,氢气会带出水蒸气,导致氢气的质量增加,所以结果会偏大;
Ⅱ、(1)由于过氧化钠能与水及二氧化碳反应,且钠能与水反应,因此利用氢氧化钠溶液除去空气中的二氧化碳,利用浓硫酸干燥空气,所以上述装置Ⅳ中盛放的试剂是浓硫酸,为完成实验应将装置Ⅳ接在Ⅰ和Ⅱ之间,答案选B;(2)由于空气中含有水蒸气和二氧化碳,则装置Ⅲ中碱石灰的作用是防止空气中的水蒸气和二氧化碳进入Ⅱ中。(3)根据以上分析可知为制得更纯的Na2O2,应先通空气后点燃酒精灯。(4)点燃酒精灯后,观察到装置II中的现象为钠熔化成光亮的小球,剧烈燃烧产生黄色火焰,生成淡黄色固体。

【题目】在100℃时,将0.200mol的四氧化二氮气体充入2L真空的密闭容器中,每隔一定的时间对该容器内的物质进行分析,得到如表格:
| 0 | 2 | 4 | 6 | 8 | 10 |
c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:
(1)该反应达到平衡时,四氧化二氮的转化率为%,表中c2c3、ab(填“>”、“<”或“=”).
(2)2min时四氧化二氮的浓度c1=mol/L,在0~2min时间段内,四氧化二氮的平均反应速率为mol/(Lmin).
(3)100℃时,该反应的平衡常数K=
(4)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是mol/L.