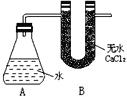
题目内容
【题目】指出下列反应中的氧化剂和还原剂。
(1)Cl2 + SO2 + 2H2O = H2SO4 + 2HCl;氧化剂:___________,还原剂:___________;
(2)2KNO3+S+3C ![]() K2S+N2↑+3CO2↑;氧化剂:___________,还原剂:___________;
K2S+N2↑+3CO2↑;氧化剂:___________,还原剂:___________;
(3)4FeS2 + 11O2 ![]() 2Fe2O3 + 8SO2;氧化剂:___________,还原剂:___________。
2Fe2O3 + 8SO2;氧化剂:___________,还原剂:___________。
【答案】 Cl2 SO2 KNO3和S C O2 FeS2
【解析】本题考查氧化还原反应中几个概念,氧化剂是化合价降低的物质,还原剂是化合价升高的物质,(1)Cl2中Cl的化合价由0价→-1价,化合价降低,Cl2作氧化剂,SO2中S的化合价由+4价→+6价,化合价升高,即SO2作还原剂;(2)KNO3中N的化合价由+5价→0价,化合价降低,KNO3作氧化剂,S的化合价由0价→-2价,化合价降低,S作氧化剂,C的化合价由0价→+4价,化合价升高,C作还原剂;(3)FeS2中Fe显+2价,转化成+3价,化合价升高, S的化合价由-1价→+4价,化合价升高,即FeS2作还原剂,氧气的化合价降低,即O2作氧化剂。

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目