题目内容
已知有关物质的熔沸点数据如下表:
| MgO | Al2O3 | MgCl2 | AlCl3 |
熔点/℃ | 2 852 | 2 072 | 714 | 190(2.5×105 Pa) |
沸点/℃ | 3 600 | 2 980 | 1 412 | 182.7 |
请参考上述数据填空和回答问题:
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。为什么不用电解MgO的方法生产镁,也不用电解AlCl3的方法生产铝?
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是__________________。
解析:本题应运用各种晶体的性质差异解答。因为MgO的熔点远高于MgCl2,所以电解熔融的MgO需提供更多的能量,更高的温度,不易于操作。从表中数据可以发现,AlCl3晶体的熔点很低,且沸点比熔点低,易升华,属于分子晶体,不存在离子,熔融时不能导电,不能被电解。
答案:(1)MgO的熔点太高,电解MgO消耗能量多,经济效益低;AlCl3晶体为分子晶体,在熔融状态不电离、不导电,无法进行电解。
(2)将MgCl2晶体、AlCl3晶体分别加热熔化并作熔融体的导电性实验。若熔融体导电,则物质的晶体为离子晶体;若熔融体不导电,则物质的晶体为分子晶体。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案下图是某工厂对海水资源进行综合利用的示意图.
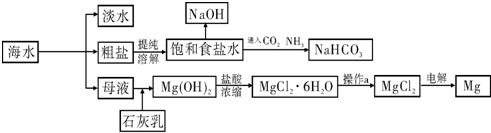
请回答下列问题:
(1)请列举一种海水淡化的方法
(2)工业上常用离子交换膜电解槽生产NaOH,电解过程中大量通过离子交换膜的离子是
(3)侯氏制碱法中首先向饱和食盐水中通入CO2和NH3制得NaHCO3,先通入
(填化学式),理由是
(4)镁是一种用途很广泛的金属材料,目前世界上60%的镁从海水中提取.已知有关物质的熔沸点数据如下:
| MgO | MgCl2 | |
| 熔点/℃ | 2852 | 714 |
| 沸点/℃ | 3600 | 1412 |
| 物质 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 熔点(℃) | 2850 | 2072 | 714 | 190(2.5×105Pa) |
| 沸点(℃) | 3600 | 2980 | 1412 | 182.7 |
工业上常用电解熔融的MgCl2方法生产金属镁,电解Al2O3和冰晶石的熔融体的方法生产铝,为什么不用电解MgO的方法生产镁?也不用电解氯化铝的方法生产铝?
几种物质的熔沸点
| MgO | Al2O3 | MgCl2 | AlCl3 |
熔点/℃ | 2852 | 2072 | 714 | 190(2.5×107 Pa) |
沸点/℃ | 3600 | 2980 | 1412 | 182.7 |
请参考上述数据填空和完成下列问题:
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。不用电解MgO的方法生产镁的原因是________________________ ,你认为可以用什么方法生产镁;不用电解AlCl3的方法生产铝的原因是_______________________。
(2)请设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是__________。
(3)AlCl3具有以下______________性质(请填序号)。
①液化 ②挥发 ③升华
已知有关物质的熔沸点数据如下表:
| MgO | Al2O3 | MgCl2 | AlCl3 | |
| 熔点/℃ | 2852 | 2072 | 714 | 190(2.5×105Pa) |
| 沸点/℃ | 3600 | 2980 | 1412 | 182.7 |
请参考上述数据填空和回答问题:
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。为什么不用电解MgO的方法生产镁,也不用电解AlCl3的方法生产铝?答:____________________。
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是__________________。