题目内容
 在如图所示的实验装置中,A中盛有品红溶液,B 中盛有NaOH溶液.
在如图所示的实验装置中,A中盛有品红溶液,B 中盛有NaOH溶液.请回答下列问题:
(1)若向A中通入足量的二氧化硫气体,A中的现象是
红色褪去
红色褪去
.(2)如果A中盛的是浓硫酸,加入铜,加热反应,此反应中表现浓硫酸的酸性和
强氧化
强氧化
性.(3)如果A中盛的是浓盐酸,加入二氧化锰,加热反应,此反应中浓盐酸的作用是
作酸和还原剂
作酸和还原剂
.分析:(1)二氧化硫能使品红溶液褪色;
(2)A中盛的是浓硫酸,加入铜,加热反应,发生Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;
(3)A中盛的是浓盐酸,加入二氧化锰,加热反应,发生MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,以此来解答.
(2)A中盛的是浓硫酸,加入铜,加热反应,发生Cu+2H2SO4(浓)
| ||
(3)A中盛的是浓盐酸,加入二氧化锰,加热反应,发生MnO2+4HCl(浓)
| ||
解答:解:(1)A中盛有品红溶液,二氧化硫能使品红溶液褪色,向A中通入足量的二氧化硫气体,观察到红色褪去,故答案为:红色褪去;
(2)A中盛的是浓硫酸,加入铜,加热发生Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,生成硫酸铜体现浓硫酸的酸性,生成二氧化硫体现浓硫酸的强氧化性,故答案为:强氧化;
(3)A中盛的是浓盐酸,加入二氧化锰,加热反应,发生MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,生成氯化锰体现浓盐酸的酸性,生成氯气体现其还原性,此反应中浓盐酸的作用为作酸和还原剂,故答案为:作酸和还原剂.
(2)A中盛的是浓硫酸,加入铜,加热发生Cu+2H2SO4(浓)
| ||
(3)A中盛的是浓盐酸,加入二氧化锰,加热反应,发生MnO2+4HCl(浓)
| ||
点评:本题考查二氧化硫和浓酸的化学性质,结合氧化还原反应来分析酸的作用是解答本题的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 在如图所示的实验装置中,E为一张用淀粉、碘化钾和酚酞混合溶液润湿的滤纸,C,D为夹在滤纸两端的铂夹,X,Y分别为直流电源的两极.在A,B中充满KOH溶液后倒立于盛有KOH溶液的水槽中,再分别插入铂电极.切断电源开关S1,闭合开关S2,通直流电一段时间后,请回答下列问题:
在如图所示的实验装置中,E为一张用淀粉、碘化钾和酚酞混合溶液润湿的滤纸,C,D为夹在滤纸两端的铂夹,X,Y分别为直流电源的两极.在A,B中充满KOH溶液后倒立于盛有KOH溶液的水槽中,再分别插入铂电极.切断电源开关S1,闭合开关S2,通直流电一段时间后,请回答下列问题: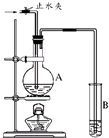 在如图所示的实验装置中,A中盛有品红溶液,B 中盛有NaOH溶液.
在如图所示的实验装置中,A中盛有品红溶液,B 中盛有NaOH溶液.
