题目内容
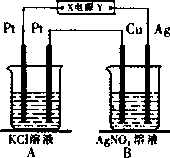
铅蓄电池放电时发生下列变化:负极:Pb+SO42—-2e-===PbSO4 正极:PbO2+4H++SO42—+2e-===PbSO4+2H2O,使用该电池电解CuSO4溶液,要得到纯铜1.6 g,这时铅蓄电池消耗的H2SO4的物质的量为
- A.0.025 mol
- B.0.05 mol
- C.0.1 mol
- D.0.2 mol
B
1.6g铜是0.025mol,转移电子是0.05mol。根据电极反应式可知,每转移2mol电子,消耗2mol硫酸,所以根据电子的得失守恒可知,消耗硫酸是0.05mol,答案选B。
1.6g铜是0.025mol,转移电子是0.05mol。根据电极反应式可知,每转移2mol电子,消耗2mol硫酸,所以根据电子的得失守恒可知,消耗硫酸是0.05mol,答案选B。

练习册系列答案
相关题目
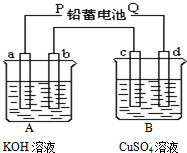 如图装置实验,A、B两烧杯分别盛放200g10%KOH和足量CuSO4溶液.通电一段时间后,c极增重3.2g.
如图装置实验,A、B两烧杯分别盛放200g10%KOH和足量CuSO4溶液.通电一段时间后,c极增重3.2g.