题目内容
【题目】研究NOx、CO等大气污染气体的处理,对保护环境有重要的意义。回答下列问题:
(1)NOx与CO反应生成无污染气体的相关热化学方程式如下:①NO2(g)+CO(g)![]() CO2(g)+NO(g) ΔH1=234.0 kJ·mol1,②N2(g) +O2(g)
CO2(g)+NO(g) ΔH1=234.0 kJ·mol1,②N2(g) +O2(g)![]() 2NO(g)ΔH2=+179.5 kJ·mol1,③2NO(g)+O2(g)
2NO(g)ΔH2=+179.5 kJ·mol1,③2NO(g)+O2(g)![]() 2NO2(g) ΔH3=112.3 kJ·mol1,反应2NO2(g) +4CO(g)
2NO2(g) ΔH3=112.3 kJ·mol1,反应2NO2(g) +4CO(g)![]() N2(g)+4CO2(g)的ΔH=__________ kJ·mol1。
N2(g)+4CO2(g)的ΔH=__________ kJ·mol1。
(2)在一定温度下,向2 L的恒容密闭容器中充入4.0 mol NO2和4.0 mol CO,在催化剂作用下发生反应:2NO2(g)+4CO(g)![]() N2(g) +4CO2(g),测得相关数据如下:
N2(g) +4CO2(g),测得相关数据如下:
0 min | 5 min | 10 min | 15 min | 20 min | |
c(NO2)/mol·L1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2)/mol·L1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①在0~10 min,用CO2的浓度变化表示的反应速率为______________。
②为使该反应的反应速率增大,下列措施中可采用的是________(填字母代号)。
a.减小压强 b.适当升高温度 c.增大CO的浓度 d.选择高效催化剂
(3)如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
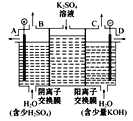
①该电解槽的阳极反应式为_______。此时通过阴离子交换膜的离子数____(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口____(/span>填“A”“B”“C”或“D”)导出。
③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池负极的电极反应式为_____。
【答案】-1227.8 0.088 mol·L1 min1 bcd 2H2O-4e-=O2↑+4H+ 或4OH--4e-=2H2O+O2↑ 小于 D 2H2+4OH--4e-=4H2O
【解析】
(1)根据盖斯定律,反应2NO2(g) +4CO(g)![]() N2(g)+4CO2(g)可由①×4+③-②得到,因此,该反应的△H=ΔH1×4+ΔH3-ΔH2= -1227.8 kJ·mol1;
N2(g)+4CO2(g)可由①×4+③-②得到,因此,该反应的△H=ΔH1×4+ΔH3-ΔH2= -1227.8 kJ·mol1;
(2)①在0~10 min,用N2的浓度变化表示的反应速率为![]() ,则用CO2的浓度变化表示的反应速率为
,则用CO2的浓度变化表示的反应速率为![]() ;
;
②为使反应的反应速率增大,可采用的措施是增大反应物浓度、增大压强、升高温度、加入催化剂等,因此本题可选bcd;
(3)①电解硫酸钾溶液的阳极为水中的氢氧根离子放电,反应式为2H2O-4e-=O2↑+4H+ 或4OH--4e-=2H2O+O2↑;阳极氢氧根离子放电,因此硫酸根离子向阳极移动,阴极氢离子放电,因此钠离子向阴极移动,所以通过相同电量时,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数;
②电解硫酸钾溶液的阴极为氢离子放电,会生成氢氧根,因此制得的氢氧化钾溶液从出口D导出;
③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则负极应为氢气,则电池负极的电极反应式为2H2+4OH--4e-=4H2O。

 阅读快车系列答案
阅读快车系列答案【题目】为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸60.0mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如下表:
实验序号 | I | II | III | IV |
盐酸体积(mL) | 60.0 | 60.0 | 60.0 | 60.0 |
样品质量(g) | 2.96 | 3.70 | 5.18 | 6.66 |
CO2体积(mL) | 672 | 840 | 896 | 672 |
(1)样品中物质的量之比n(NaHCO3):n(Na2CO3)=___。
(2)盐酸的物质的量浓度c(HCl)=___。