题目内容
在常温下的密闭容器中放入一定量的CH4,O2和足量Na2O2,用电火花不断引燃,待反应完全后,恢复到原温度,容器内压强几乎为0,求:
(1)容器内CH4和O2的物质的量之比应为________.
(2)若容器中Na2O2的质量为23.4g,则容器中O2的质量范围m为________.
答案:2∶1;m≤1.6g
解析:
解析:
|
(1)2∶1;(2)m≤1.6g 导解:该反应过程为:CH4和O2开始燃烧后生成的CO2和H2O与Na2O2反应又生成了O2,这些O2再参加CH4的燃烧反应,形成循环过程.最后容器中压强为0,则要求起始投入的CH4,O2及反应过程中生成的O2全部消耗尽,而Na2O2为固体,可以有剩余,且余量多少对容器的压强无影响.设起始CH4为1mol,完全燃烧后将生成CO2 1mol和H2O 2mol,它们与足量Na2O2反应可生成O2 1.5mol,所以容器起始投入的O2只需要0.5mol,故容器中CH4与O2的物质的量之比为2∶1. |

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
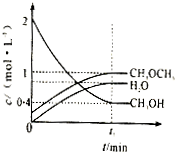 Ⅰ.(1)利用水煤气合成二甲醚(CH3OCH3)的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),△H=-274KJ/mol.该反应在一定条件下的密闭容器中达到平衡后,为同时提高反应速率和二甲醚的产率,可以采取的措施是
Ⅰ.(1)利用水煤气合成二甲醚(CH3OCH3)的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),△H=-274KJ/mol.该反应在一定条件下的密闭容器中达到平衡后,为同时提高反应速率和二甲醚的产率,可以采取的措施是