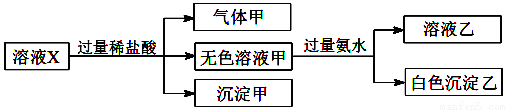
题目内容
氯化锶晶体在工业上常用作铝的缓蚀剂。工业上一般用难溶于水的的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体(SrCl2•6H2O)的过程为:

已知:Ⅰ.SrCl2•6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水;
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
(1)操作①在 实际工业生产中常常把碳酸锶粉碎并加以搅拌,其目的是 。碳酸锶与盐酸反应的化学方程式为__________________。
实际工业生产中常常把碳酸锶粉碎并加以搅拌,其目的是 。碳酸锶与盐酸反应的化学方程式为__________________。
(2)操作②在 酸性条件下,加入30% H2O2溶液的目的是: 。
酸性条件下,加入30% H2O2溶液的目的是: 。
(3)操作③将溶液的pH值由1调节至 (填选项);所得滤渣的主要成分是 (填化学 式)。
式)。
A.1.5 B.4 C.7 D.9.7
(4)工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是 。
(5)操作⑥中,洗涤氯化锶晶体最好选用___________。
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液
(6)若滤液中Ba2+ 浓度为1×10-5mol/L,则滤液中Sr2+物质的量浓度不大于 mol/L。
(已知:Ksp[SrSO4]=3.3×10-7,Ksp[BaSO4]=1.1×10-10)
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案SO2随意排放会造成严重的大气污染。下列是某小组同学设计处理烟气(主要含SO2、N2、O2、粉尘)中SO2的方法。
(1)方法一:利用氯碱工业产品处理SO2的烟气,流程如下:

①“吸收装置”中发生反应的离子方程式_____________________。
②合成塔中每合成1mol气体放出热量92.3kJ(25℃、101kPa),反应的热化学方程式_____________。
③上述流程中循环利用的物质是____________________。
(2)方法二:利用FeCl3溶液氧化吸收烟气中SO2
①该反应的离子方程式________________________(反应a)。为验证该反应,同学们将SO2通入0.05mol/LFeCl3溶液中,溶液很快由 黄色变为红褐色;将溶液长时间放置后,最终变
黄色变为红褐色;将溶液长时间放置后,最终变 为浅绿色。关于红褐色液体,以下是同学们的分析推测
为浅绿色。关于红褐色液体,以下是同学们的分析推测 与
与 实验。
实验。
分析推测 | 实验步骤及现象 |
甲:生成了Fe(OH)3胶体 乙: Fe3++6SO2 | I、制备Fe(OH)3胶体并检验 II、分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
②利用胶体的_________________(填性质)可以检验步骤I中是否得到了Fe(OH)3胶体。
③根据反应b说明步骤II中液体颜色变化的原因是______________________(用离子方程式及必要的文字说明)。



 染,常采用氢氧化钠溶液进行吸收处理。反应方程式:2NO2 + 2NaOH=NaNO3 + NaNO2 + H2O;NO2 + NO + 2NaOH=2NaNO2+H2O 现有由a mol NO、b m
染,常采用氢氧化钠溶液进行吸收处理。反应方程式:2NO2 + 2NaOH=NaNO3 + NaNO2 + H2O;NO2 + NO + 2NaOH=2NaNO2+H2O 现有由a mol NO、b m ol NO2、c mol N2O4组成的混合气体恰好被V L氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度为( ) mol/L
ol NO2、c mol N2O4组成的混合气体恰好被V L氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度为( ) mol/L B.
B.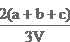 C.
C.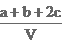 D.
D.
 经查阅资料,可能发生反应:
经查阅资料,可能发生反应: Fe(SO2)63+(反应b)
Fe(SO2)63+(反应b)