��Ŀ����
����Ŀ���Ȼ����dz�����ˮ�����������÷���м���Ʊ���ˮ�Ȼ�����ʵ�����Ʊ�װ�ú�ҵ�Ʊ�����ͼ��ͼ��
��֪������ˮFeCl3���۵�Ϊ555K���е�Ϊ588K��
�ڷ���м�е����ʲ������ᷴӦ
�۲�ͬ�¶�����ˮ���Ȼ�����ˮ�е��ܽ�������
�¶�/�� | 0 | 20 | 80 | 100 |
�ܽ�ȣ�g/100 g H2O�� | 74.4 | 91.8 | 525.8 | 535.7 |
ʵ�����Ʊ������������£�
����ɼ�K1 �� �رյ��ɼ�K2 �� ������a�������μ����ᣮ
��װ��A�в��������ݻ������ܺ�ˮ��Һ�治��ʱ���رյ��ɼ�K1 �� ���ɼ�K2 �� ��A����Һ��ȫ�����ձ���رջ���a��
���ձ�����Һ����һϵ�в�����õ�FeCl36H2O���壮
��1���ձ���������H2O2��Һ�������� ��
��2��Ϊ�˲ⶨ����м�����������������������С������������� ��
��3����FeCl3��Һ�Ƶ�FeCl36H2O����IJ��������ǣ�����������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ����
��4����д���������з�Ӧ�����ӷ���ʽ�� ��
��5���������¶ȳ���673Kʱ��������Է�������Ϊ325�������Ȼ�������ʵķ���ʽΪ
��6��FeCl3����������ͨ�����õ������ⶨ����ȡm g��ˮ�Ȼ�����Ʒ������ϡ���ᣬ���Ƴ�100mL��Һ��ȡ��10.00mL�������Թ�����KI��Һ����ַ�Ӧ���뼸�ε�����Һ������c molL��1 Na2S2O3��Һ�ζ�������V mL����֪��I2+2S2O32���T2I��+S4O62������
�ٵζ������п������ʵ����ƫ�͵���
A����ƿδ��ϴ B����ƿ����Һ��ɫ������ֹͣ�ζ������ж���
C���ζ��ܼ����ڵζ�ǰ�����ݣ��ζ��յ㷢������ D���ζ��յ�ʱ���Ӷ���
����Ʒ���Ȼ���������������
���𰸡�
��1������������ȫ������������������
��2��װ��A�в��������ݻ������ܺ�ˮ��Һ�治��
��3������
��4��2Fe2++Cl2=2Fe3++2Cl��
��5��Fe2Cl6
��6��BC��![]()
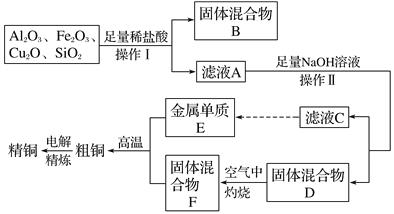
���������⣺��1������ʵ��װ�úͲ��������֪��ʵ�����Ʊ���ˮFeCl3 �� �������������ᷴӦ����FeCl2 �� Ȼ���FeCl2������FeCl3 �� ���Ƶ�FeCl36H2O���壬���ѽᾧˮ�Ƶ���ˮFeCl3 �� �ձ���������H2O2��Һ����������������������ȫ�����������������ӣ�
���Դ��ǣ�����������ȫ�����������������ӣ���2���������ᷴӦ��ȫʱ�����ٲ�������������װ��A�в��������ݻ������ܺ�ˮ�ܵ�Һ�治�ٱ仯����ʱ���ɽ�A��FeCl2��Һ�����ձ��н���������
���Դ��ǣ�װ��A�в��������ݻ������ܺ�ˮ��Һ�治�䣻��3����FeCl3��Һ�Ƶ�FeCl36H2O����IJ��������ǣ��������������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ����
���Դ��ǣ������4���ӹ�ҵ�Ʊ�����ͼ������֪����Ӧ¯�н��еķ�Ӧ�� 2Fe+3Cl2=2FeCl3 �� ��ˣ������������е�β����û�вμӷ�Ӧ���������������������������ռ����գ���Ӧ������2FeCl3��Һ���������ռ�Ӧ��2FeCl2��Һ����Ӧ�����ӷ���ʽΪ��2Fe2++Cl2=2Fe3++2Cl����
���Դ��ǣ�2Fe2++Cl2=2Fe3++2Cl������5���������ռ�������̬FeCl3 �� FeCl3����Է���������162.5������Է�������Ϊ325�������Ȼ�������Ƴ������¶ȳ���673Kʱ����������̬FeCl3���Ծۺ�����˫����Fe2Cl6��
���Դ��ǣ�Fe2Cl6����6����A����ƿδ��ϴ�����±�Һ��ϡ�ͣ����ĵı�Һ���ƫ�ߣ���ⶨ���ƫ��A����
B����ƿ����Һ��ɫ������ֹͣ�ζ�����ӦҺδ��ֻ�ϣ����ж�����Һʹ��ƫ�٣��ⶨ���ƫ�ͣ���B��ȷ��
C���ζ��ܼ����ڵζ�ǰ�����ݣ��ζ��յ㷢�����ݣ����Һ�������ƫС���ⶨ���ƫ�ͣ���C��ȷ��
D���ζ��յ�ʱ���Ӷ�����������ʵ��ƫ�ⶨ���ƫ��D����
���Դ��ǣ�BC��
���ɷ�Ӧ��2Fe3++2I ��=2Fe2++I2�� I2+2S2O32���T2I��+S4O62�����ɵù�ϵʽ��
2Fe3+��I2�� | 2S2O32�� |
1 | 1 |
n | cV��10��3 |
���� n��Fe3+��=cV10��3 mol��10=0.01cVmol��
����m����ˮ�Ȼ�����Ʒ���Ȼ���������Ϊ0.01cVmol��162.5g/mol=1.625cVg
����m����ˮ�Ȼ�����Ʒ���Ȼ�������������Ϊ ![]() =
= ![]() %��
%��
���Դ��ǣ� ![]() ��
��

����Ŀ���ں��ݾ��ȣ�������罻�������������½���2A��g��+B��g��3C��g��+2D��s����Ӧ�����±�����Ͷ�ϣ���Ӧ�ﵽƽ��״̬�������ϵѹǿ���ߣ�
���� | A | B | C | D |
��ʼͶ��/mol | 2 | 2 | 3 | 0 |
�÷�Ӧ��ƽ�ⳣ������ʽΪK= �� �����¶ȣ�ƽ�ⳣ�������������С�����䡱����