题目内容
一种海水电池的反应原理可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,有关该反应的说法正确的是
| A.反应中MnO2是还原剂 |
| B.Ag的还原性比Na2Mn5O10强 |
| C.该反应中MnO2具有催化作用 |
| D.每生成1 mol Na2Mn5O10转移1 mol电子 |
B
试题分析:A、该反应中锰元素的化合价由+4价→+
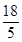 价,所以二氧化锰得电子作氧化剂,故A错误;B、该反应中,银是还原剂,Na2Mn5O10是还原产物,所以银的还原性比Na2Mn5O10强,故B正确;C、该反应中,二氧化锰参加反应作氧化剂,故C错误;D、每生成1 molNa2Mn5O10转移(4-
价,所以二氧化锰得电子作氧化剂,故A错误;B、该反应中,银是还原剂,Na2Mn5O10是还原产物,所以银的还原性比Na2Mn5O10强,故B正确;C、该反应中,二氧化锰参加反应作氧化剂,故C错误;D、每生成1 molNa2Mn5O10转移(4-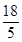 )mol×5="2" mol电子,故D错误;故选B。
)mol×5="2" mol电子,故D错误;故选B。
练习册系列答案
相关题目


 Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。