题目内容
2.3g某有机物A完全燃烧后,生成0.1 mol CO2和 2.7gH2O,测得该化合物的蒸气与空气的相对密度是1.6,求该化合物的分子式。
(1)求2.3g该有机物中组成元素的质量:
C: C → CO2
12 44
m(C) 44g/mol×0.1mol

=1.2g
H: 2H → H2O
2 18
m(H) 2.7g

=0.3g
m(C)+m(H)=1.2g+0.3g=1.5g<2.3g
该有机物中C的质量与H的质量之和(1.5g)小于该有机物的质量
(2.3g),因此该有机物A中还含有O,其质量为:
m(O)=m(A)-m(C)-m(H)
=2.3g-1.5g
=0.8g
(2)求该有机物的相对分子质量:
Mr(A)=d×Mr(空气)
=1.6×29
=46
(3)求该有机物分子中各元素原子的数目:

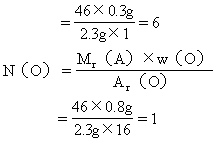
答:该有机物的分子式是C2H6O。
C: C → CO2
12 44
m(C) 44g/mol×0.1mol

=1.2g
H: 2H → H2O
2 18
m(H) 2.7g

=0.3g
m(C)+m(H)=1.2g+0.3g=1.5g<2.3g
该有机物中C的质量与H的质量之和(1.5g)小于该有机物的质量
(2.3g),因此该有机物A中还含有O,其质量为:
m(O)=m(A)-m(C)-m(H)
=2.3g-1.5g
=0.8g
(2)求该有机物的相对分子质量:
Mr(A)=d×Mr(空气)
=1.6×29
=46
(3)求该有机物分子中各元素原子的数目:

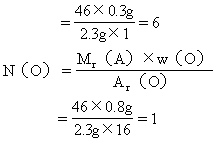
答:该有机物的分子式是C2H6O。
根据实验,该有机物燃烧的产物只有CO2和H2O,因此,该有机物中一定含有C和H;至于O,由于其可能全部来自于燃烧时空气所提供的氧气,也可能来自于该有机物本身。因此,该有机物分子中是否含有O,还需要通过计算反应物中C、H质量之和并与该有机物质量进行比较后,才能作出判断。该有机物的相对分子质量,则可以利用实验测出的相对密度来求。

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目