��Ŀ����
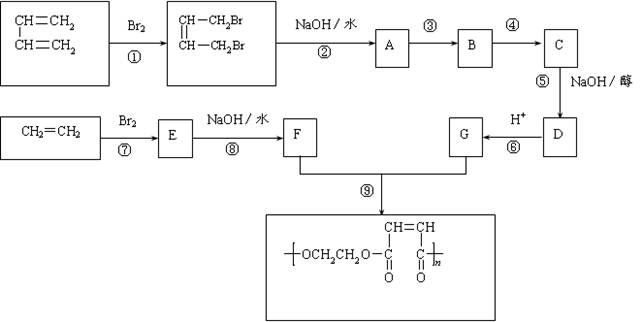
�������������ֲ��Ͷ�������һ�������·��Ͷ��õļ��飺
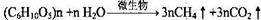
��ijֲ����ά�صĺ���Ϊ10%��ij�����أ��������ֲ��162kg����������������ȫת���ɵ�CH4�ڱ�״���µ����Ϊ m3��
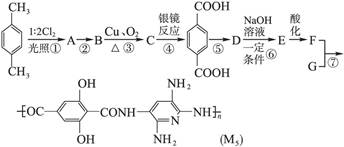
�ƺϳɶ�������Ҫ����Ϊ�����ͺϳɡ��������£�
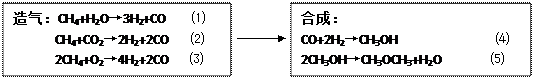 |
������ʱ����ÿ��ת���ʾ�Ϊ100%����ij��Ȼ����ֻ��5%CO2�������������ʣ�ÿ100m3��Ȼ����Ӧͬʱͨ��ˮ�����Ϳ������������������ֻ��N2��O2���������Ϊ4��1����ͬ�������ܱ�֤�ϳ�ʱCO��H2������á�V[H2O��g��]= m3��V[����]= m3��
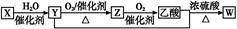
��Ϊ�˳�����÷�Ӧ���������ɵıȽϴ����ĵ�����ij��ҵ����Ȼ��Ϊ��Ҫԭ���������������ѺͰ����������£�
�����豸����CH4+H2O �� CO+3H2 ��2CH4+O2 �� 2CO+4H2
�ϳ�����CO+2H2 �� CH3OH �� 2CH3OH �� CH3OCH3+H2O
�ϳ�����N2+3H2==2NH3
������Ȼ����ֻ��CH4����Ӧ����ͨ���������������ڢٺ͢�Ͷ���CH4��������ʹ��Ӧ��ʣ���H2�ͷ�Ӧ��ʣ���N2�������ǡ��Ϊ3��1���Ա�ϳɰ�������ҵÿ����34t NH3������ͬʱ���Եõ������Ѷ��ٶ֣����蹤ҵ���ת������ת���ʼٶ�Ϊ100%��ϳ�������ˮ��CO����Ӧ����
��1��6.72m3 (2��) (2)10m3,200m3 (ÿ��2��) (3)80.5t (4��)
���⿼��ಽ��Ӧ�Ļ�ѧ���㣬��ϵ���ӣ��ѶȽϴ����׳�������һ�������ۺ�˼ά���������ֶȺõ����⡣(1)(C6H10O5) n ~ 3nCH4,��C6H10O5 ~ 3CH4
n(CH4)=3n(C6H10O5) =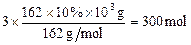
V(CH4)=300mol��22.4L/mol=6.72��103L=6.72m3
(2)�����⣬100m3��Ȼ����CH495m3��CO25m3���۲�ϳɷ�Ӧ��CO:H2=1:2ʱ���ܳ�����á��ٹ۲�������Ӧ����Ӧ��1�������ǣ�2����2�����ܴﵽ����Ҫ����֪��Ӧ��2����CH4Ϊ5m3����Ӧ��1����CH4Ϊ10m3��ͬʱ��ˮ10m3�����Է�Ӧ��3����CH4Ϊ80m3����O240m3��������200m3��
��3���ɷ�ӦN2+3H2==2NH3���������34t����1��106molN2��3��106molH2����Ӧ��ͨ���O2Ϊ1��1/4=0.25��106mol������H21��106mol����Ӧ��Ӧ����H29��106mol���������ںϳ�CH3OCH3��H2Ϊ6��106mol���ɹ�ϵʽ4H2 ~ CH3OCH3����ã�n(CH3OCH3)=��1��106+6��106��mol��1/4=1.75��106mol��Ϊ80.5t��
n(CH4)=3n(C6H10O5) =
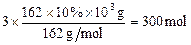
V(CH4)=300mol��22.4L/mol=6.72��103L=6.72m3
(2)�����⣬100m3��Ȼ����CH495m3��CO25m3���۲�ϳɷ�Ӧ��CO:H2=1:2ʱ���ܳ�����á��ٹ۲�������Ӧ����Ӧ��1�������ǣ�2����2�����ܴﵽ����Ҫ����֪��Ӧ��2����CH4Ϊ5m3����Ӧ��1����CH4Ϊ10m3��ͬʱ��ˮ10m3�����Է�Ӧ��3����CH4Ϊ80m3����O240m3��������200m3��
��3���ɷ�ӦN2+3H2==2NH3���������34t����1��106molN2��3��106molH2����Ӧ��ͨ���O2Ϊ1��1/4=0.25��106mol������H21��106mol����Ӧ��Ӧ����H29��106mol���������ںϳ�CH3OCH3��H2Ϊ6��106mol���ɹ�ϵʽ4H2 ~ CH3OCH3����ã�n(CH3OCH3)=��1��106+6��106��mol��1/4=1.75��106mol��Ϊ80.5t��

��ϰ��ϵ�д�
 �ο�������ϵ�д�
�ο�������ϵ�д� ������ѧ��ʱ��ҵϵ�д�
������ѧ��ʱ��ҵϵ�д� ���������ʱ��ѵϵ�д�
���������ʱ��ѵϵ�д� �㽭�¿γ���άĿ�������ʱ��ѵϵ�д�
�㽭�¿γ���άĿ�������ʱ��ѵϵ�д�
�����Ŀ