题目内容
【题目】我国著名有机化学家张绪穆于2000年在JACS杂志上公布了著名的“张烯炔异构化反应”及其机理。该反应丰富了人类进行天然有机分子全合成的手段,该反应原理如下:
其中:—R、—R’、—R’’可以为—H、—CH3、—CH2CH3或![]() ,—X—可以为—O—、—NH—或CH2—
,—X—可以为—O—、—NH—或CH2—
现拟合成![]() 应选取的反应物是( )
应选取的反应物是( )
A.CH3—C![]() C—CH2—O—CH2—CH=CH—CH3
C—CH2—O—CH2—CH=CH—CH3
B.CH3—C![]() C—CH2—O—CH2—CH2—CH=CH2
C—CH2—O—CH2—CH2—CH=CH2
C.CH3—C![]() C—CH2—O—CH2—CH=CH—CH2—CH3
C—CH2—O—CH2—CH=CH—CH2—CH3
D.CH3—C![]() C—CH2—O—CH2—CH2—CH=CH—CH3
C—CH2—O—CH2—CH2—CH=CH—CH3
【答案】C
【解析】
由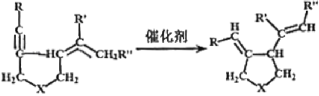 可知,反应前后碳原子数目不变,碳碳三键变为双键,另一侧单双键交换了位置,从这个角度判断合成
可知,反应前后碳原子数目不变,碳碳三键变为双键,另一侧单双键交换了位置,从这个角度判断合成![]() 应选取的反应物。
应选取的反应物。
由 可知,反应前后碳原子数目不变,碳碳三键变为双键,另一侧单双键交换了位置,故合成
可知,反应前后碳原子数目不变,碳碳三键变为双键,另一侧单双键交换了位置,故合成![]() 应选取的反应物为CH3—C
应选取的反应物为CH3—C![]() C—CH2—O—CH2—CH=CH—CH2—CH3,故答案为C。
C—CH2—O—CH2—CH=CH—CH2—CH3,故答案为C。

【题目】(1)某温度下,纯水中的c(H+)=2.0×10-7mol·L-1,则此时溶液的c(OH-)=________ mol·L-1;若温度不变,滴入稀盐酸使c(H+)=5.0×10-6 mol·L-1,则c(OH-)=_________ mol·L-1。
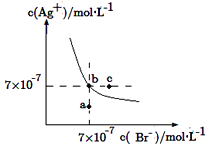
(2)在2mL 0.1mol·L-1的NaCl溶液中,加入2mL 0.1mol·L-1的AgNO3溶液,可观察到白色沉淀生成。将此混合液过滤,向滤渣中加入2mL 0.1mol·L-1的KI溶液,搅拌,可观察到_______________, 反应的离子方程式为______________________。
(3)下列说法不正确的是_____________。
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
B.所有物质的溶解都是吸热的
C.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全
D.除去溶液中的Mg2+,用OH-沉淀Mg2+比![]() 用效果好,说明 Mg(OH)2的溶解度比MgCO3大
用效果好,说明 Mg(OH)2的溶解度比MgCO3大
(4)25 ℃,两种常见酸的电离常数如下表所示。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①![]() 的电离常数表达式 K =_____________。
的电离常数表达式 K =_____________。
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为______________。
【题目】完成下列问题:
(1)25℃时有下列4种溶液:
A.0.01mol/L氨水 B.0.01mol/LNaOH溶液
C.pH=2的CH3COOH溶液 D.pH=2的HCl溶液
请回答下列问题:
①上述4种溶液中,水的电离程度最大的是________(填序号)。
②若将B、C溶液等体积混合,所得溶液pH_______7(填“>”、“<”或“=”)
(2)已知25℃时
物质 | H3PO2 | H2S | 一元酸HA |
Ka | Ka=5.9×10-2 | Ka1=9.1×10-8 Ka2=1.1×10-12 | Ka=1.1×10-10 |
①一元酸H3PO2的电离方程式为_________________________。
②H2S溶液与NaA溶液反应的化学方程式为________________。
③经测定,25℃时0.01mol/LNa2S溶液的pH为11,则c(H+)+c(HS-)+2c(H2S)=______。
④0.1mol/L的NaHS溶液,测得溶液显_______。则该溶液中c(H2S)____c(S2-)(填“>”、“<”或“=”),作出上述判断的依据是__________(用计算和文字解释)。
(3)①25℃时,亚硝酸的电离常数为Ka=1.0×10-5,0.2mol/L的HNO2溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,混合溶液中各离子和HNO2分子浓度由大到小的顺序为_____________。

(4)如图是甲醇燃料电池工作示意图,其中A,B,D均为石墨电极,C为铜电极。
①甲中负极的电极反应式____________________。
②乙中B极的电极反应式____________________。
③丙中C极的电极反应式___________________。
【题目】下列实验操作、对应的现象以及结论都正确且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 往1mL 0.1mol/L AgNO3溶液中滴入2滴0.1 mol/L 的NaCl溶液,再往混合溶液中滴入2滴0.1 mol/L KI溶液,充分振荡 | 先产生白色沉淀,后出现黄色沉淀 | Ksp(AgCl) >Ksp (AgI) |
B | 一定条件下,密闭容器反应达平衡: H2(g)+I2(g) | 气体颜色加深 | 平衡逆移 |
C | 等体积、等pH的HA和HB两种酸溶液分别与足量的大小相同的锌反应 | 反应开始后HA产生H2的速率更快 | HA是弱酸 |
D | 向锌粒与稀硫酸反应的试管中滴加几滴CuSO4溶液 | 产生气体的速率明显加快 | CuSO4对该反应有催化作用 |
A.AB.BC.CD.D