题目内容
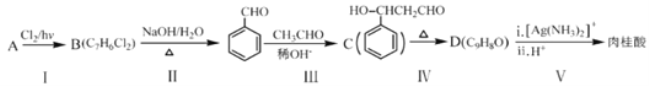
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:

(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是_________________________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
ⅰ:2Fe2++PbO2+4H++SO42-=2Fe3++PbSO4+2H2O
ⅱ:……
写出ⅱ的离子方程式:______________________。
(3)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq),其溶解度曲线如图所示。过程Ⅱ的目的是脱硫。滤液1经处理后可在过程Ⅱ中重复使用,其目的是_________(选填序号)。
NaHPbO2(aq),其溶解度曲线如图所示。过程Ⅱ的目的是脱硫。滤液1经处理后可在过程Ⅱ中重复使用,其目的是_________(选填序号)。

A.减少PbO的损失,提高产品的产率
B.重复利用氢氧化钠,提高原料的利用率
C.增加Na2SO4浓度,提高脱硫效率
(4)PbO2在加热的过程中发生分解生成PbO和O2,其失重曲线如图所示,已知失重曲线上的a点为样品分解40%的残留固体,若a点固体组成表示为PbOx,则x=_________。

【答案】 Pb+PbO2+H2SO4=2PbSO4+H2O Pb+2Fe3++SO42-=PbSO4+2Fe2+ AB 1.6
【解析】本题考查了化学工艺流程分析,离子方程式的书写、化学实验方案的谁、物质的分离提纯等,难度中等。
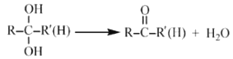
(1)根据题给化学工艺流程可知,过程Ⅰ中,在亚铁离子催化下,Pb和PbO2反应生成PbSO4和水,方程式为: Pb+PbO2+H2SO4=2PbSO4+H2O。(2)规划及通过参加反应,改变反应历程,降低反应的活化能,加快反应速率,而本身的质量和化学性质前后保持不变,根据题给信息可知反应中亚铁被二氧化铅氧化为铁离子,则反应ⅱ中铁离子被铅还原为亚铁离子,离子方程式为: Pb+2Fe3++SO42-=PbSO4+2Fe2+。 (3) 过程Ⅱ中脱硫过程中发生的反应为PbO2+ 2NaOH=PbO+Na2SO4+H2O,由于氧化铅能溶解于氢氧化钠溶液,因此滤液Ⅰ中含有铅元素,滤液Ⅰ重复使用可以减少氧化铅的损失,提高产品的差率,且滤液Ⅰ中过量的氢氧化钠可以重复使用,提高原料的利用率,因此选AB。 (4) PbO2在加热的过程中发生分解生成PbO和O2,a点分解49%,假设取1mol二氧化铅,40%分解,即0.4mol分解生成0.4mol氧化铅,则产物中含有0.6mol二氧化铅和0.4mol氧化铅,则铅和氧原子个数比为(0.6+0.4):(0.6×2+0.4)=1:1.6,故答案为:1.6。

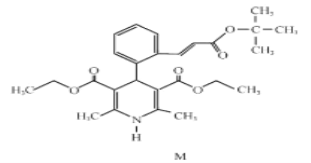
【题目】下列叙述正确的是
A |
| 两个有机反应的反应类型都是加成反应 |
B | H2O+2SO2 +CO32-=CO2 +2HSO3- H2O+CO2 +SiO32-=H2CO3↓ +CO32- | 由这两个反应不能得出非金属性:S> C> Si |
C | 2F2+2H2O=4HF+O2 2Na2O2+2H2O=4NaOH+O2↑ | 两个反应中的H2O均被氧化 |
D | NH4++H2O H2PO4-+H2O | 两个离子方程式均为水解方程式 |
A. A B. B C. C D. D