题目内容
①取少量废液,滴加KSCN溶液显红色.
②取10mL废液,加入足量的AgNO3溶液,析出沉淀8.61g.
③另取10mL废液,加入一定质量的铜片,充分反应后,测得铜片的质量减少了0.256g,再向反应后的溶液中滴加KSCN溶液不变色.
根据探究实验得出结论:
(1)废液中含有的金属离子是
(2)10mL废液中氯离子的物质的量浓度是
(3)10mL废液中铜离子的物质的量是
②沉淀8.61 g为氯化银,物质的量是0.06mol;
③溶液中Fe3+和Cu发生了反应:2Fe3++Cu═Cu2++2Fe2+,利用反应方程式计算出Fe3+的物质的量.
(1)根据以上分析判断出废液中含有的金属离子;
(2)根据氯离子守恒,由②中氯化银的物质的量进行计算;
(3)根据反应 2Fe3++Cu═Cu2++2Fe2+ 和氯化铁的物质的量,计算出氯化铁完全反应消耗的铜的物质的量,③中消耗了铜0.004mol,从而计算出废液中的铜离子的物质的量.
②析出沉淀8.61 g是氯化银,物质的量是0.06mol;
③发生了反应:2Fe3++Cu═Cu2++2Fe2+; 参加反应的铜的物质的量是0.004mol,故n(Fe3+)=0.008mol;
(1)根据①的现象和反应2Fe3++Cu═Cu2++2Fe2+,废液中含有的金属离子是:Fe3+、Cu2+、Fe2+,故答案为:Fe3+、Cu2+、Fe2+;
(2)根据氯离子守恒,n(Cl-)=n(AgCl)=0.06mol,氯离子的浓度为:
| 0.06mol |
| 0,01L |
(3)原溶液中含有的氯化铁的物质的量是:
| n(Cl-) |
| 3 |

 特高级教师点拨系列答案
特高级教师点拨系列答案某工厂废液中含有苯酚、乙酸,实验小组对该废液进行探究,设计如下方案:
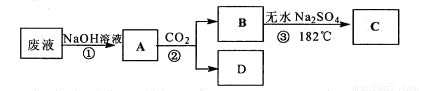
己知熔点:乙酸16.6℃、苯酚43℃。沸点:乙酸118℃、苯酚182℃。
(1)写出②的反应化学方程式 。
(2)②中分离B的操作名称是 。
(3)现对物质C的性质进行实验探究,请你帮助实验小组按要求完成实验过程记录,在答题卡上填写出实验操作、预期现象和现象解释。
限选试剂:蒸馏水、稀HNO3、2moL·L—1NaOH、0.1 mol •L—1KSCN、酸性KMnO4溶 液、FeCl3溶液、饱和溴水、紫色石蕊试液。
|
实验操作 |
预期现象 |
现象解释 |
|
步骤1:取少量C放入a试管,加入少量蒸馏水,振荡。 |
|
|
|
步骤2:取少量C的稀溶液分装b、c两支试管,往b试管
|
产生白色沉淀
|
|
|
步骤3:往c试管
|
|
C与加入的试剂发生显色反应。 |
(4)称取一定量的C试样,用水溶解后全部转移至1000mL容量瓶中定容。取此溶液 25.00mL,加入浓度为0.0500 moL·L-1的溴水溶液30.00mL,放置。待反应完全后,加入过量的KI,再用0.1100 moL•L-1Na2S2O3标准溶液滴定生成的I2,耗去Na2S2O3标准溶液11.80mL。则试样中C物质的量的计算表达式为: 。 (部分反应离子方程式:I2+2S2O32—=2I—+S4O62—)