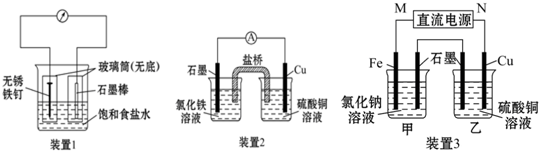
题目内容
2.将4g氢氧化钠溶解在10mL水中,再稀释成1L,从中取出10mL,这10mL溶液的物质的量浓度是( )| A. | 1 mol•L-1 | B. | 0.1 mol•L-1 | C. | 0.01 mol•L-1 | D. | 10 mol•L-1 |
分析 根据n=$\frac{m}{M}$计算NaOH物质的量,再根据c=$\frac{n}{V}$计算稀释后溶液中NaOH的物质的量浓度,溶液是均一的,取出溶液浓度与原溶液浓度相等.
解答 解:4g氢氧化钠的物质的量为$\frac{4g}{40g/mol}$=0.1mol,溶解在10mL水中,再稀释成1L,稀释后溶液中NaOH的物质的量浓度为$\frac{0.1mol}{1L}$=0.1mol/L,溶液是均一的,取出溶液浓度与原溶液浓度相等,即从稀释后的反应中取出的10mL溶液的物质的量浓度是0.1mol/L,
故选:B.
点评 本题考查物质的量浓度与溶液性质,比较基础,旨在考查学生对基础知识的理解掌握.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目
10.近日来,全国安全事故频发,折射出人们对化学品与安全知识的极度缺乏,下列有关化学品与安全的说法或操作正确的是( )
| A. | 运液氯可用钢瓶装,车上应贴 标志.装运浓硫酸可用铝槽罐车,应贴 标志.装运浓硫酸可用铝槽罐车,应贴 标志 标志 | |
| B. | 冬天严禁在窗门紧闭的室内用煤饼炉取暖,因为生成的CO、CO2等容易引起中毒 | |
| C. | 洁厕灵和厨房清洁剂不 能混合使用,因为会反应生成Cl2引起中毒 | |
| D. | 患有胃溃疡的患者治疗胃酸过多,可用长期大量服用含Al(OH)3的胃药 |
7.下列离子方程式表示正确的是( )
| A. | AgNO3 溶液中加入Cu:Cu+Ag+=Cu2++Ag | |
| B. | NaHCO3溶液中加入CH3COOH:CO32-+2CH3COOH=CO2↑+2CH3COO-+H2O | |
| C. | 含0.2mol FeBr2 的溶液中通入0.2mol Cl2:4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl- | |
| D. | 等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
14.一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+.下列有关说法正确的是( )
| A. | 检测时,电解质溶液中的H+向负极移动 | |
| B. | 若有0.4mol电子转移,则在标准状况下消耗4.48 L氧气 | |
| C. | 电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O | |
| D. | 正极上发生的反应为O2+4e-+2H2O═4OH- |
12.下列说法正确的是( )
| A. | 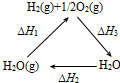 图中△H1=△H2+△H3 | |
| B. | 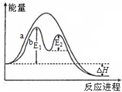 如图在催化剂条件下,反应的活化能等于E1+E2 | |
| C. |  如图表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线 | |
| D. | 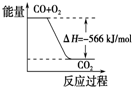 如图可表示由CO(g)生成CO2(g)的过程中要放出566kJ 热量 |