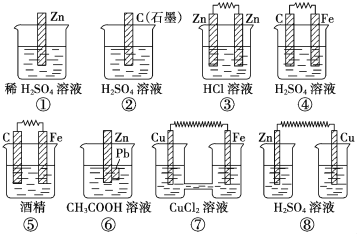
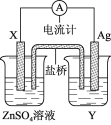
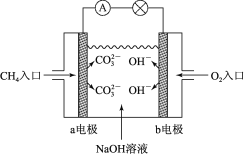
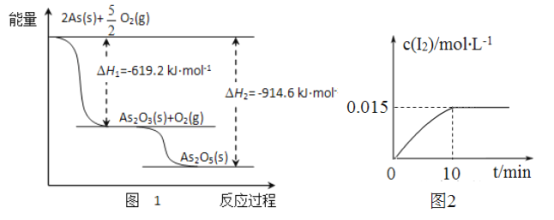
题目内容
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表所示:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表所示:
T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应的化学平衡常数表达式为K=_____________________________。
(2)该反应为________反应(填“吸热”或“放热”)。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________ ℃。此温度下加入1 mol CO2(g)和1 mol H2(g),充分反应,达到平衡时,CO2的转化率为________。
(4)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,则正、逆反应速率的比较为v正________v逆(填“>”、“<”或“=”)。
【答案】 ![]() 吸热 830 50% <
吸热 830 50% <
【解析】分析:(1)根据化学反应方程式和化学平衡常数的概念书写K的表达式;
(2)根据温度对化学平衡和化学平衡常数的影响分析;
(3)根据化学平衡常数K和温度t的关系分析;
(4)根据800℃时,![]() 与K比较判断反应方向,如果
与K比较判断反应方向,如果![]() >K,则反应向逆反应方向移动,如果
>K,则反应向逆反应方向移动,如果![]() =K,则反应达到平衡状态,如果
=K,则反应达到平衡状态,如果![]() <K,则反应向正反应方向移动。
<K,则反应向正反应方向移动。
详解:(1)已知化学反应: CO2(g)+H2(g)![]() CO(g)+H2O(g),因平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K=
CO(g)+H2O(g),因平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K=![]() ;因此,本题正确答案是:
;因此,本题正确答案是:![]() ;
;
(2)化学平衡常数的大小只与温度有关,升高温度,平衡向吸热的方向移动,由表可以知道:升高温度,化学平衡常数增大,说明化学平衡正向移动,因此正反应方向吸热,因此,本题正确答案是:吸热;
(3)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),即![]() =1,由表中数据可以知道,K=1时温度为830℃;
=1,由表中数据可以知道,K=1时温度为830℃;
设反应的CO2为xmol,则消耗的H2为xmol,生成CO和H2O均是xmol,用三行式分析如下:
CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
起始物质的量(mol) 1 1 0 0
转化物质的量(mol) x x x x
平衡物质的量(mol)1-x 1-x x x
K=![]() =
=![]() =1,解得x=0.5,则CO2的转化率为
=1,解得x=0.5,则CO2的转化率为![]() ×100%=50%。
×100%=50%。
因此,本题正确答案是:830;50%;
(4)![]() =
=![]() =1>0.9,所以v正<v逆。
=1>0.9,所以v正<v逆。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案