题目内容
【题目】将0.65g锌加到50.0mL浓度为1.00mol·L-1的盐酸溶液中,试计算:(写出计算过程)
(1)在标准状况下,可生成氢气的体积_________?
(2)若反应完成后,溶液体积仍为50.0mL,这时溶液中的锌离子浓度和氢离子浓度各为多少?c(Zn2+)_________、c(H+)___________。
【答案】0.224L 0.2mol/L 0.6mol/L
【解析】
(1)锌和盐酸反应生成氯化锌和氢气,依据化学方程式定量关系计算得到;
(2)依据化学方程式计算生成的锌离子物质的量,剩余氢离子物质的量,c=![]() 计算浓度。
计算浓度。
(1)0.65g锌的物质的量n(Zn)=0.65g÷65g/mol=0.01mol,50mL 1mol/L的盐酸中溶质物质的量n(HCl)=0.050L×1mol/L=0.05mol;锌和盐酸反应生成氯化锌和氢气,反应方程式为:Zn+2HCl=ZnCl2+H2↑,根据反应方程式中物质消耗关系可知氯化氢过量,依据反应的锌物质的量计算生成氢气物质的量为0.01mol,其标准状况下气体体积V(H2)=0.01mol×22.4L/mol=0.224L;
(2)由化学方程式可知生成的锌离子物质的量为0.01mol,剩余氢离子物质的量=0.05mol-0.02mol=0.03mol,若反应结束后,溶液的体积仍为50mL依据c=![]() 计算浓度,c(Zn2+)=0.01mol÷0.05L=0.2mol/L,c(H+)=0.03mol÷0.05L=0.6mol/L。
计算浓度,c(Zn2+)=0.01mol÷0.05L=0.2mol/L,c(H+)=0.03mol÷0.05L=0.6mol/L。

 阅读快车系列答案
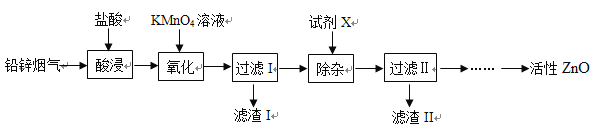
阅读快车系列答案【题目】钴元素由于其良好的物理化学性质,被广泛应用于生产生活中。从含钴废料(含CoO、Co2O3、单质Al、Li等)中制取粗CoCl2·6H2O的流程如下所示。

请回答下列问题:
(1)步骤I中主要发生的化学反应方程式为______。
(2)已知Co2O3具有强氧化性,若步骤II中浸出剂为盐酸,造成的后果是_______。
(3)步骤Ⅲ中①的目的是除去Al3+,写出该步反应的离子方程式______。
(4)若在实验室煅烧CoCO3,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有______、______(填仪器名称)。
(5)操作①是在HCl氛围中进行的,其步骤是______、_____、过滤、洗涤、干燥。洗涤过程中可以用工业酒精代替水,其优点是_____。
(6)某同学用标准硝酸银溶液滴定未知浓度的CoCl2溶液,下列可作为指示剂的是____(填选项,忽略亚钴离子的颜色干扰)
A.KCl B.KSCN C.K2CrO4 D.K2S
已知几种物质在20℃时的颜色及Ksp值如下表
化学式 | AgCl | AgSCN | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黑色 | 红色 |
Ksp | 2.0×10-10 | 1.0×10-12 | 2.0×10-48 | 2.0×10-12 |