题目内容
【题目】对于可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A. 达到化学平衡前,化学反应速率:2v (NH3)=3v (H2O)
B. 若单位时间内生成x mol NO,同时消耗x mol NH3,则反应达到化学平衡状态
C. 达到化学平衡状态时,若增大容器体积,则正反应速率减小,逆反应速率增大
D. 达到化学平衡状态时,4v正(O2)=5v逆(NO)
【答案】D
【解析】
A项,反应速率之比等于化学计量数之比,则3v正(NH3)=2v正(H2O),A错误;
B项,无论是否达到平衡状态,反应速率之比都等于化学计量数之比,即单位时间内生成x mol NO的同时,必然消耗x mol NH3,但不能说明正逆反应速率相等,B错误;
C项,达到化学平衡时,若增加容器体积,容器的压强减小,物质的浓度减小,正逆反应速率都减小,C错误;
D项,反应达到平衡状态时,正逆反应速率相等,4v正(O2)=5v逆(NO),说明消耗氧气的速率和生成氧气的速率相等,D正确。
答案选D。

【题目】工业合成氨的反应如下:3H2+N2![]() 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50 s内的平均反应速率 v(N2)=_______________。
(2)250 s时,H2的转化率为_______________。
(3)已知N≡N的键能为946 kJ·mol-1,H-H的键能为436 kJ·mol-1,N-H的键能为391 kJ·mol-1,则生成1 mol NH3过程中的热量变化为_______kJ。下图能正确表示该反应中能量变化的是_____(填字母)。
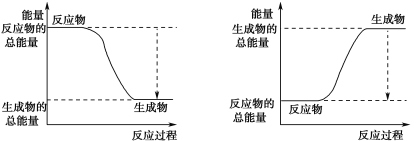
A B
(4)为加快反应速率,可以采取的措施______________。
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离出NH3
(5)下列说法错误的是____________。
a.使用催化剂是为了加快反应速率,提高生产效率
b.上述条件下,N2不可能100%转化为NH3
c.在一定条件下,合成氨反应有一定的限度
d.250~350 s时,生成物浓度保持不变,反应停止