题目内容
(1)NaHCO3溶液呈碱性的原因是 (写出有关的离子方程式,下同),Al2(SO4)3溶液呈酸性的原因是 ,将NaHCO3溶液跟Al2(SO4)3溶液混合,现象是 ,相关反应的离子方程式是 .
(2)写出Al(OH)3的溶解平衡方程式 Al(OH)3的Ksp表达式 .
(2)写出Al(OH)3的溶解平衡方程式
考点:盐类水解的应用,难溶电解质的溶解平衡及沉淀转化的本质
专题:盐类的水解专题
分析:(1)NaHCO3水解溶液呈碱性,Al2(SO4)3在溶液中水解显酸性,二者混合发生相互促进的水解,生成二氧化碳和氢氧化铝;
(2)氢氧化铝沉淀在水中电离出铝离子和氢氧根离子;根据Ksp的含义书写;
(2)氢氧化铝沉淀在水中电离出铝离子和氢氧根离子;根据Ksp的含义书写;
解答:
解:(1)HCO3-水解,反应为:HCO3-+H2O H2CO3+OH-,溶液呈碱性;
H2CO3+OH-,溶液呈碱性;
Al3+水解,反应为:Al3++3H2O Al(OH)3+3H+,Al2(SO4)3溶液呈酸性;
Al(OH)3+3H+,Al2(SO4)3溶液呈酸性;
NaHCO3溶液跟Al2(SO4)3溶液混合,发生相互促进的水解:3HCO3-+Al3+=3CO2↑+Al(OH)3↓,产生大量的气体和沉淀,
故答案为:HCO3-+H2O H2CO3+OH-;Al3++3H2O
H2CO3+OH-;Al3++3H2O Al(OH)3+3H+;产生大量的气体和沉淀;3HCO3-+Al3+=3CO2↑+Al(OH)3↓;
Al(OH)3+3H+;产生大量的气体和沉淀;3HCO3-+Al3+=3CO2↑+Al(OH)3↓;
(2)氢氧化铝沉淀在水中电离出铝离子和氢氧根离子,溶解方程式为Al(OH)3(S)?Al3+(aq)+3OH-(aq);Al(OH)3的Ksp表达式:Ksp=c(Al3+)?c3(OH-)
故答案为:Al(OH)3(S)?Al3+(aq)+3OH-(aq);Ksp=c(Al3+)?c3(OH-).
 H2CO3+OH-,溶液呈碱性;
H2CO3+OH-,溶液呈碱性;Al3+水解,反应为:Al3++3H2O
 Al(OH)3+3H+,Al2(SO4)3溶液呈酸性;
Al(OH)3+3H+,Al2(SO4)3溶液呈酸性;NaHCO3溶液跟Al2(SO4)3溶液混合,发生相互促进的水解:3HCO3-+Al3+=3CO2↑+Al(OH)3↓,产生大量的气体和沉淀,
故答案为:HCO3-+H2O
 H2CO3+OH-;Al3++3H2O
H2CO3+OH-;Al3++3H2O Al(OH)3+3H+;产生大量的气体和沉淀;3HCO3-+Al3+=3CO2↑+Al(OH)3↓;
Al(OH)3+3H+;产生大量的气体和沉淀;3HCO3-+Al3+=3CO2↑+Al(OH)3↓;(2)氢氧化铝沉淀在水中电离出铝离子和氢氧根离子,溶解方程式为Al(OH)3(S)?Al3+(aq)+3OH-(aq);Al(OH)3的Ksp表达式:Ksp=c(Al3+)?c3(OH-)
故答案为:Al(OH)3(S)?Al3+(aq)+3OH-(aq);Ksp=c(Al3+)?c3(OH-).
点评:本题考查了盐的水解、难溶电解质的溶解平衡,侧重于基础知识的考查,难度不大,注意把握盐类水解的实质和应用.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、需要加热才能发生的反应就一定是吸热反应 |
| B、每个化学反应都伴随着能量的变化 |
| C、燃料的燃烧反应都是放热反应 |
| D、化学反应的能量变化与反应物的总能量、生成物的总能量有关 |
下列叙述中,正确的是( )
| A、两种微粒,若核外电子排布完全相同,则其化学性质一定相同 |
| B、两种原子,如果核外电子排布相同,则它们的关系为互为同位素 |
| C、凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 |
| D、阴离子的核外电子排布与上周期稀有气体元素原子的核外电子排布相同 |
 有机物的结构简式为(如图),试判断它具有的官能团:
有机物的结构简式为(如图),试判断它具有的官能团: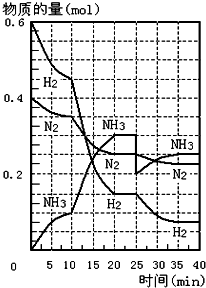 在一定条件下,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图:
在一定条件下,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图: