题目内容
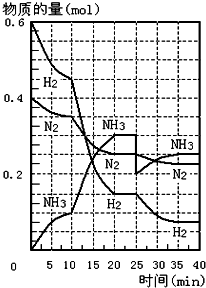 在一定条件下,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图:
在一定条件下,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图:(1)计算反应开始10分钟内,NH3的平均反应速率
(2)反应处于平衡状态的时间是:
(3)图中10~20分钟曲线发生变化的可能原因是
(4)第25分钟,平衡改变的条件是
(5)判断该反应达到平衡状态的标志是
a.N2和NH3浓度相等 b.NH3百分含量保持不变
c.容器中气体的压强不变 d.NH3的生成速率与H2的消耗速率相等
e.容器中混合气体的密度保持不变
(6)若在上述的密闭容器中充入0.80mol N2(g)和1.60mol H2(g),反应在一定条件下达到平衡时,NH3的体积分数为20%.
①该条件下反应2NH3(g)?N2(g)十3H2(g)的平衡常数为
②相同条件下,在另一相同容器中充入a mol N2(g)和b mol H2(g),达到平衡时,测得容器中NH3为0.8mol,H2为2.0mol,则a=
考点:物质的量或浓度随时间的变化曲线,反应速率的定量表示方法,化学平衡状态的判断,化学平衡的计算
专题:化学平衡专题
分析:(1)根据v=
计算反应速率;
(2)达到平衡状态时,物质的量不变,以此判断达到平衡的时间段;
(3)由图象可知各组分物质的量变化增快,且10min时是连续的,三种气体物质的速率增加倍数相同,说明为使用催化剂;
(4)第25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3;
(5)当反应达到化学平衡状态时,正逆反应速率相等,各物质的浓度不再改变;
(6)令转化的氮气的物质的量为ymol,利用三段式表示出平衡时各组分的物质的量,根据氨气的体积分数列方程计算y的值,计算平衡浓度,倒入平衡常数表达式计算;
(7)温度恒定体积恒定,平称常数不变,应用三行式求解.
| △c |
| △t |
(2)达到平衡状态时,物质的量不变,以此判断达到平衡的时间段;
(3)由图象可知各组分物质的量变化增快,且10min时是连续的,三种气体物质的速率增加倍数相同,说明为使用催化剂;
(4)第25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3;
(5)当反应达到化学平衡状态时,正逆反应速率相等,各物质的浓度不再改变;
(6)令转化的氮气的物质的量为ymol,利用三段式表示出平衡时各组分的物质的量,根据氨气的体积分数列方程计算y的值,计算平衡浓度,倒入平衡常数表达式计算;
(7)温度恒定体积恒定,平称常数不变,应用三行式求解.
解答:
解:(1)v(NH3)=
=0.005mol?L-1?min-1,故答案为:0.005mol?L-1?min-1;
(2)由图象可以看出,当反应进行到时20-25min,35-40min,各物质的量不变,说明反应达到平衡状态,故答案为:20-25min,35-40min;
(3)由图可知,0-10分钟内△n(N2)=0.025mol×2=0.05mol;10-20分钟内△n′(N2)=0.025mol×4=0.1mol,速率之比等于物质的量之比,所以,0-10分钟与10到20分钟两个时间段中,N2的反应速率之比为0.05mol:0.1mol=1:2;
由图象可知各组分物质的量变化增快,且10min时变化是连续的,20min达平衡时,△n′(N2)=0.025mol×4=0.1mol,
△n(H2)=0.025mol×12=0.3mol,△n(NH3)=0.025mol×8=0.2mol,物质的量变化之比等于化学计量数之比,三种气体物质的速率增加倍数相同,说明10min可能改变的条件是使用催化剂,
故答案为:使用了催化剂;
(4)第25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3,生成物的浓度减小,平衡向正反应方向进行,正反应速率减小,重新达平衡后,NH3的体积分数比原平衡大,
故答案为:分离出0.1molNH3; 减小;增大;
(5)a.N2和NH3浓度是否相等取决于反应的起始量和转化的程度,不能判断是否达到平衡,故a错误;
b.NH3百分含量保持不变,说明反应达到平衡状态,故b正确;
c.反应前后气体的物质的量不等,容器中气体的压强不变,说明达到平衡状态,故c正确;
d.NH3的生成速率与H2的消耗速率相等,正逆反应速率不等,没有达到平衡状态,故d错误;
e.由于气体的质量和容器的体积不变,则无论是否达到平衡状态,容器中混合气体的密度都保持不变,故e错误;
故答案为:bc;
(6)令平衡时转化的氮气的物质的量为ymol,则:
N2(g)+3H2(g)?2NH3(g)
开始(mol):0.8 1.6 0
变化(mol):x 3x 2x
平衡(mol):0.8-x 1.6-3x 2x
故
=20%,解得x=0.2,
故 N2、H2、NH3的平衡浓度分别为
=0.3mol/L、
=0.5mol/L、
=0.2mol/L
故该温度下平衡常数k=
=1.07,
所以该条件下反应2NH3(g)?N2(g)十3H2(g)的平衡常数为0.9375,故答案为:0.9375;
(7)N2(g)+3H2(g)?2NH3(g)
开始(mol):a b 0
变化(mol):x 3x 2x
平衡(mol):a-x b-3x 2x
达到平衡时,测得容器中NH3为0.8mol,则2x=0.8mol,x=0.4mol;所以
K=
=1.07,所以a=0.7,所以b-3x=2,所以b=2+3x=3.2mol,
故答案为:0.7;3.2.
| ||
| 10min |
(2)由图象可以看出,当反应进行到时20-25min,35-40min,各物质的量不变,说明反应达到平衡状态,故答案为:20-25min,35-40min;
(3)由图可知,0-10分钟内△n(N2)=0.025mol×2=0.05mol;10-20分钟内△n′(N2)=0.025mol×4=0.1mol,速率之比等于物质的量之比,所以,0-10分钟与10到20分钟两个时间段中,N2的反应速率之比为0.05mol:0.1mol=1:2;
由图象可知各组分物质的量变化增快,且10min时变化是连续的,20min达平衡时,△n′(N2)=0.025mol×4=0.1mol,
△n(H2)=0.025mol×12=0.3mol,△n(NH3)=0.025mol×8=0.2mol,物质的量变化之比等于化学计量数之比,三种气体物质的速率增加倍数相同,说明10min可能改变的条件是使用催化剂,
故答案为:使用了催化剂;
(4)第25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3,生成物的浓度减小,平衡向正反应方向进行,正反应速率减小,重新达平衡后,NH3的体积分数比原平衡大,
故答案为:分离出0.1molNH3; 减小;增大;
(5)a.N2和NH3浓度是否相等取决于反应的起始量和转化的程度,不能判断是否达到平衡,故a错误;
b.NH3百分含量保持不变,说明反应达到平衡状态,故b正确;
c.反应前后气体的物质的量不等,容器中气体的压强不变,说明达到平衡状态,故c正确;
d.NH3的生成速率与H2的消耗速率相等,正逆反应速率不等,没有达到平衡状态,故d错误;
e.由于气体的质量和容器的体积不变,则无论是否达到平衡状态,容器中混合气体的密度都保持不变,故e错误;
故答案为:bc;
(6)令平衡时转化的氮气的物质的量为ymol,则:
N2(g)+3H2(g)?2NH3(g)
开始(mol):0.8 1.6 0
变化(mol):x 3x 2x
平衡(mol):0.8-x 1.6-3x 2x
故
| 2x |
| 0.8-x+1.6-3x+2x |
故 N2、H2、NH3的平衡浓度分别为
| 0.8mol-0.2mol |
| 2L |
| 1.6mol-3×0.2mol |
| 2L |
| 2×0.2mol |
| 2L |
故该温度下平衡常数k=
| 0.22 |
| 0.3×0.53 |
所以该条件下反应2NH3(g)?N2(g)十3H2(g)的平衡常数为0.9375,故答案为:0.9375;
(7)N2(g)+3H2(g)?2NH3(g)
开始(mol):a b 0
变化(mol):x 3x 2x
平衡(mol):a-x b-3x 2x
达到平衡时,测得容器中NH3为0.8mol,则2x=0.8mol,x=0.4mol;所以
K=
(
| ||||
|
故答案为:0.7;3.2.
点评:本题考查化学平衡的计算、平衡移动以及平衡状态的判断,题目难度中等,注意对图象的分析和平衡常数的应用.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
下列有关材料的说法不正确的是( )
| A、航天飞机使用的隔热陶瓷瓦为复合材料 |
| B、复合材料由基体和增强体组成 |
| C、复合材料既保持原有材料的特点,又有优于原材料的特性 |
| D、纯金属的性能一般优于合金 |
下列液体均处于25℃,有关叙述不正确的是( )
| A、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
| B、pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)<c(CH3COO-) |
| C、AgCl在同浓度的CaCl2和NaCl溶液中的溶解度不相同 |
| D、某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 |

 已知在25℃、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题(H2O相对分子质量为18):
已知在25℃、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题(H2O相对分子质量为18): KClO3和KHSO3溶液混合发生氧化还原反应,结果氯元素被还原成最低价,硫元素被氧化成最高价,又知该反应速率随溶液中c(H+)增加而加快,反应过程中速率变化如图.
KClO3和KHSO3溶液混合发生氧化还原反应,结果氯元素被还原成最低价,硫元素被氧化成最高价,又知该反应速率随溶液中c(H+)增加而加快,反应过程中速率变化如图.