题目内容
18.有机物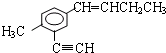 中,同一平面上碳原子最多数目和同一直线上的碳原子最多数目分别为( )
中,同一平面上碳原子最多数目和同一直线上的碳原子最多数目分别为( )| A. | 11、4 | B. | 10、3 | C. | 12、3 | D. | 13、4 |
分析 在常见的有机化合物中甲烷是正四面体结构,乙烯和苯是平面型结构,乙炔是直线型结构,其它有机物可在此基础上进行共线、共面分析判断,注意单键可以旋转.
解答 解:在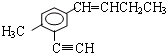 分子中,甲基中C原子处于苯中H原子的位置;苯环平面与碳碳双键形成的平面通过旋转碳碳单键可以处于同一平面,乙基中连接双键的C原子处于碳碳双键形成的平面,乙基中的亚甲基具有四面体结构,乙基中甲基C原子通过旋转碳碳单键可能处于碳碳双键形成的平面,乙炔基为直线结构,处于苯环的平面结构;故苯环中6个C原子、甲基中1个C原子、乙炔基中2个C原子、碳碳双键中2个C原子、乙基中2个C原子,可能处于同一平面,所以最多有13个C原子;有机物
分子中,甲基中C原子处于苯中H原子的位置;苯环平面与碳碳双键形成的平面通过旋转碳碳单键可以处于同一平面,乙基中连接双键的C原子处于碳碳双键形成的平面,乙基中的亚甲基具有四面体结构,乙基中甲基C原子通过旋转碳碳单键可能处于碳碳双键形成的平面,乙炔基为直线结构,处于苯环的平面结构;故苯环中6个C原子、甲基中1个C原子、乙炔基中2个C原子、碳碳双键中2个C原子、乙基中2个C原子,可能处于同一平面,所以最多有13个C原子;有机物 中,处于共线的碳原子最多的是:乙炔基、乙炔基连接的苯环C原子及该C原子对称的苯环C原子,故最多有4个C原子共线,故选D.
中,处于共线的碳原子最多的是:乙炔基、乙炔基连接的苯环C原子及该C原子对称的苯环C原子,故最多有4个C原子共线,故选D.
点评 本题考查有机物结构中共面、共线问题,难度中等,关键是空间想象,做题时注意从甲烷、乙烯、苯和乙炔的结构特点判断有机分子的空间结构,单键可以旋转.

练习册系列答案
相关题目
8.已知X、Y、Z、W是原子序数依次增大的前四周期元素.X最外层电子数是次外层电子数的3倍,Y和W同主族,且Y是电负性最大的元素.Z基态原子的M层全充满,N层有1个电子.下列说法正确的是( )
| A. | X、Y均没有最高正价 | |
| B. | W最高价氧化物的水化物是最强的含氧酸 | |
| C. | Z的焰色反应显紫色 | |
| D. | 在XY2中,X显-2价 |
9.(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快.由此判断,影响化学反应速率的因素有温度和浓度.
(2)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
①哪一时间段反应速率最大2~3min(填“0~1min”或“1~2min”或“2~3min”或“3~4min”或“4~5min”).
②2~3min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为0.1mol.L-1.min-1.
③试分析1~3min时间段里,反应速率变大的主要原因反应放热成为影响速率的主要因素.
(3)对于容积固定的反应:N2(g)+3H2(g)?2NH3(g)(正反应放热),达到平衡的标志有_ABHI.
A.N2、H2、NH3的百分含量不再变化 B.总压强不变
C.N2、H2、NH3的分子数之比为1:3:2 D.N2、H2、NH3的浓度相等
E.N2、H2不再起反应 F.v(N2)=v(H2)
G.混合气体的密度不变 H.混合气体的平均相对分子质量不变
I.正反应放出的热量等于逆反应吸收的热量.
(2)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 体积/mL | 50 | 120 | 232 | 290 | 310 |
②2~3min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为0.1mol.L-1.min-1.
③试分析1~3min时间段里,反应速率变大的主要原因反应放热成为影响速率的主要因素.
(3)对于容积固定的反应:N2(g)+3H2(g)?2NH3(g)(正反应放热),达到平衡的标志有_ABHI.
A.N2、H2、NH3的百分含量不再变化 B.总压强不变
C.N2、H2、NH3的分子数之比为1:3:2 D.N2、H2、NH3的浓度相等
E.N2、H2不再起反应 F.v(N2)=v(H2)
G.混合气体的密度不变 H.混合气体的平均相对分子质量不变
I.正反应放出的热量等于逆反应吸收的热量.
13.我国稀土资源丰富.中国改革开放的总设计师邓小平同志曾经意味深长地说:“中东有石油,我们有稀土.”下列有关稀土元素${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm的说法正确的是( )
| A. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm的质量数相同 | |
| B. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm互为同素异形体 | |
| C. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm是同一种核素 | |
| D. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm的核外电子数和质子数均为62 |
3.下列物质中既含有离子键,又含有非极性共价键的是( )
| A. | NaOH | B. | Na2O2 | C. | MgCl2 | D. | CH4 |
10.短周期元素的离子aW2+、bX+、cY2-、dZ-都具有相同的电子层结构,下列推断正确的是( )
| A. | 原子半径:X>W>Y>Z | B. | 热稳定性:H2Y>HZ | ||
| C. | 离子半径:Y2->Z->W2+>X+ | D. | 碱性:W(OH)2>XOH |
7.下列有关化学用语使用正确的是( )
| A. | 次氯酸的结构式:H-Cl-O | B. | CO2的比例模型 | ||
| C. | NH4Cl的电子式: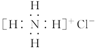 | D. | 苯乙烯的结构简式: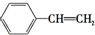 |
8.下列物质中,其水溶液能导电,溶于水时化学键被破坏,且该物质属于非电解质的是( )
| A. | I2 | B. | BaCO3 | C. | CO2 | D. | 酒精 |
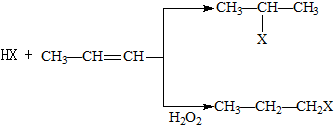 (X为卤素原子)
(X为卤素原子)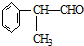 的物质,该物质是一种香料.
的物质,该物质是一种香料.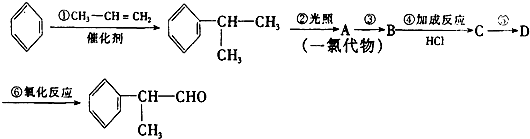
 ;
; +HCl$\stackrel{H_{2}O_{2}}{→}$
+HCl$\stackrel{H_{2}O_{2}}{→}$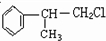 ;
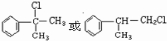
;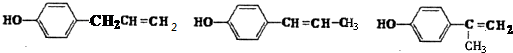 其中两种.
其中两种.