题目内容
【题目】为了将混有硫酸钠、碳酸氢铵的氯化钠提纯,并制得纯净的氯化钠溶液,某学生设计如下实验:

![]()
![]()
![]()
![]()

![]()
![]()
![]()

![]()
请回答下列问题:
(1)操作②________(填“能”或“不能”)用硝酸钡溶液,说明理由:_______________。
(2)进行操作②后,判断SO![]() 已除尽的方法是____________________。
已除尽的方法是____________________。
(3)操作③的目的是________;不先过滤就滴加碳酸钠溶液,其理由是_________。
(4)此设计方案是否严密?______(填“是”或“否”),说明理由______。
【答案】 不能 硝酸根离子会成为新的杂质,且很难除去 将滴加BaCl2溶液后的溶液静置,取少许上层清液,滴加BaCl2溶液,若无浑浊,则SO![]() 已除尽 除去过量的Ba2+ 加入的Na2CO3溶液不会使已生成的沉淀溶解,且一次过滤可以节约药品和时间 否 为了除去多余的Ba2+,加入的Na2CO3必须过量,过量的CO
已除尽 除去过量的Ba2+ 加入的Na2CO3溶液不会使已生成的沉淀溶解,且一次过滤可以节约药品和时间 否 为了除去多余的Ba2+,加入的Na2CO3必须过量,过量的CO![]() 成为新的杂质,应该再加适量的盐酸将其除去
成为新的杂质,应该再加适量的盐酸将其除去
【解析】(1)加入硝酸钠溶液,硝酸钠和硫酸钠反应生成硫酸钡和硝酸钠,除去了硫酸钠,但引入了硝酸钠等新的杂质,故答案为:不能,硝酸根离子会成为新的杂质,且很难除去;
(2)加入过量氯化钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴氯化钡溶液,不出现浑浊就说明硫酸根离子已经除尽,故答案为:取少量上层澄清溶液,再滴加BaCl2溶液,如无沉淀出现则说明SO42-已除尽;
(3)操作③加入碳酸钠溶液,碳酸钠与过量的氯化钡反应生成碳酸钡和氯化钠,除去过量的氯化钡,再过滤;先过滤而后加碳酸钠溶液,在加入碳酸钠溶液后生成的碳酸钡还需要过滤,因此一次性过滤掉BaSO4沉淀和BaCO3沉淀,可以节约药品和时间,故答案为:除去过量的Ba2+;加入的Na2CO3溶液不会使已生成的沉淀溶解,且一次过滤可以节约药品和时间;
(4)此方案不严密,过量的碳酸钠没有除去,得到的溶液中含有氯化钠和过量的碳酸钠两种溶质,致使得到的氯化钠溶液不纯,应在操作④之后加入适量盐酸除去碳酸钠,然后再加热煮沸除去HCl,故答案为:否;为了除去多余的Ba2+,加入的Na2CO3必须过量,过量的CO![]() 成为新的杂质,应该再加适量的盐酸将其除去。
成为新的杂质,应该再加适量的盐酸将其除去。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】乙酸丁酯是重要的化工原料,具有水果香味。实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:
CH3COOH+CH3CH2CH2CH2OH![]() CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
物质 | 乙酸 | 正丁醇 | 乙酸丁酯 |
熔点/ ℃ | 16.6 | -89.5 | -73.5 |
沸点/ ℃ | 117.9 | 117 | 126.0 |
密度/g·cm-3 | 1.1 | 0.80 | 0.88 |
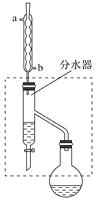
(1)乙酸丁酯粗产品的制备
在干燥的50 mL圆底烧瓶中,装入沸石,加入12.0 mL正丁醇和16.0 mL冰醋酸(过量),再加3~4滴浓硫酸。然后再安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热。将烧瓶中反应后的混合物冷却与分水器的酯层合并。装置中冷水应从________(填“a”或“b”)管口通入;通过分水器下端旋塞分出的生成物是________,其目的是_____________________________。
(2)乙酸丁酯的精制
将乙酸丁酯粗产品用如下的操作进行精制:①水洗、②蒸馏、③用无水MgSO4干燥、④用10%碳酸钠洗涤。
①正确的操作步骤是________(填标号)。
A.①②③④ B.③①④②
C.①④①③② D.④①③②③
②分液漏斗有两种,如下图。分液时应选择下图中________形分液漏斗,其原因是_____________________________________________。

③蒸馏操作时,需收集________ ℃的馏分,沸点大于140 ℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是__________。





