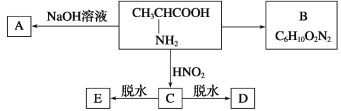
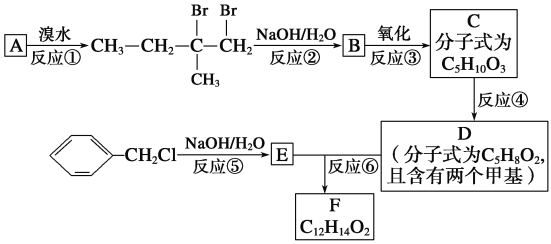
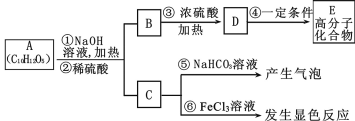
题目内容
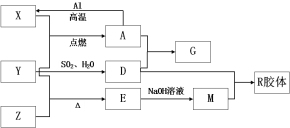
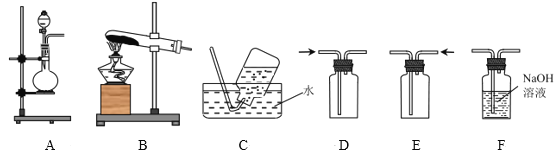
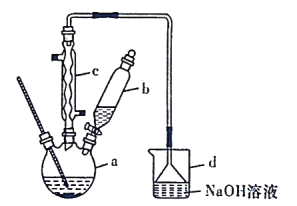
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/g/cm3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解性 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在装置a中加入15mL无水苯和少量铁屑。在装置b中小心加入4.0mL液态溴。向装置a中滴入几滴溴,有白雾产生。继续滴加至液溴滴完。装置d的作用是吸收________和少量溴蒸汽。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是________________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入无水氯化钙的目的是________________________。
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为________,要进一步提纯,下列操作中必须的是________(填字母代号)。
A.重结晶 B.过滤
C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是________(填字母代号)。
A.25mL B.50mL
C.250mL D.500mL
【答案】溴化氢(HBr) 除去未反应的Br2 干燥,吸收水分 苯 C B
【解析】
a中,Fe和溴发生氧化反应生成溴化铁,在溴化铁作催化剂条件下,苯和溴发生取代反应生成溴苯和HBr,HBr遇水蒸气生成氢溴酸小液滴而产生白雾,冷凝管有冷凝回流作用,提高反应物的利用率;生成的HBr和挥发出的溴通过导气管进入d中和氢氧化钠反应生成钠盐,结合溴苯的性质分析解答。
(1)在溴化铁作催化剂条件下,苯和溴发生取代反应生成溴苯和HBr,HBr遇水蒸气产生白雾,所以产生白雾的是HBr;溴单质具有挥发性,形成溴蒸汽,HBr、Br2蒸气不能直接排空,否则污染大气,用碱液吸收,所以d的作用是吸收HBr和Br2;
(2)②溴苯提纯的方法是:先水洗,把可溶物溶解在水中,然后过滤除去未反应的铁屑,再加NaOH溶液,把未反应的Br2变成NaBr和NaBrO洗到水中,则 NaOH溶液洗涤的作用是为除去未反应的Br2;
③无水氯化钙能吸收水分,起到干燥剂的作用;
(3)溴苯能溶于苯中,所以经以上分离操作后,溴苯中的主要杂质是苯,二者互溶应该采用蒸馏方法分离,故答案选C;
(4)操作过程中,在a中加入15mL无水苯, b中加入4.0mL液态溴,反应过程中也加入到a中,然后又向a中加入10mL水,共约30mL,所以a的容积最适合的是50mL,故答案选B。

【题目】表为元素周期表的一部分.
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为__.
(2)表中元素原子半径最大的是(写元素符号)__.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__.
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1mol Y 单质比1mol S 得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1mol X 的最高价化合物,恢复至室温,放热687kJ.已知该化合物的熔沸点分别为﹣69℃和58℃,写出该反应的热化学方程式:__.
(5)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中的两种元素组成,气体的相对分子质量都小于50.为防止污染,将生成的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol/L NaOH 溶液和1mol O2,则两种气体的分子式分别为__,物质的量分别为__,生成硫酸铜物质的量为__.