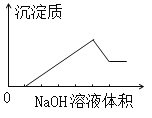
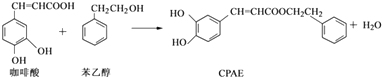
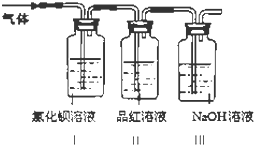
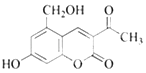
题目内容
【题目】丙烯是一种重要的化工原料.2000年以来,我国丙烯的使用量已超过乙烯,且一直保持增长趋势.现以丙烯为原料,合成环酯J. 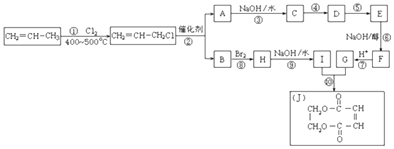
已知:烯烃复分解反应是指在催化剂作用下,实现 ![]() 两边基团换位的反应.如两个丙烯分子进行烯烃换位,生成丁烯和乙烯.
两边基团换位的反应.如两个丙烯分子进行烯烃换位,生成丁烯和乙烯.
2CH2═CHCH3 ![]() CH3CH═CHCH3+CH2═CH2
CH3CH═CHCH3+CH2═CH2
请按要求填空:
(1)反应①的化学反应类型是 .
(2)反应④是与HCl加成,设计这一步反应的目的是 .
(3)反应②的化学方程式为 .
(4)物质E的结构简式是 .
(5)有机化合物C有多种同分异构体,请写出其中属于酯类且能发生银镜反应的所有同分异构体的结构简式 .
【答案】
(1)取代反应
(2)保护分子中碳碳双键不被氧化
(3)2CH2═CH﹣CH2Cl ![]() ClCH2﹣CH═CH﹣CH2Cl+CH2═CH
ClCH2﹣CH═CH﹣CH2Cl+CH2═CH
(4)![]()
(5)HCOOCH2CH2CH3、HCOOCH(CH3)2
【解析】解:丙烯与氯气在加热条件下发生取代反应生成CH2=CHCH2Cl,由反应信息可知,CH2=CHCH2Cl在催化剂条件下发生复分解反应生成CH2=CH2、ClCH2CH=CHCH2Cl,A在氢氧化钠水溶液、加热条件下发生反应生成C,故A为ClCH2CH=CHCH2Cl,B为CH2=CH2 . B与溴发生加成反应生成H为BrCH2CH2Br,H在氢氧化钠水溶液、加热条件下发生取代反应生成I为HOCH2﹣CH2OH.A在氢氧化钠水溶液、加热条件下发生反应生成C为HOCH2CH=CHCH2OH,由J的结构可知,G为HOOC﹣CH=CH﹣COOH,由转化关系可知,结合反应④是C与HCl加成生成D,保护C=C不被氧化,D再氧化可得E,故D为HOCH2CH2CHClCH2OH,E为 ![]() ,E发生消去反应生成F,F酸化得到G,故F为NaOOC﹣CH=CH﹣COONa,(1)反应①为丙烯的取代反应,所以反应类型是取代反应,所以答案是:取代反应;(2)反应④是与HCl加成,设计这一步反应的目的是保护分子中碳碳双键不被氧化,所以答案是:保护分子中碳碳双键不被氧化;(3)该反应方程式为2CH2═CH﹣CH2Cl
,E发生消去反应生成F,F酸化得到G,故F为NaOOC﹣CH=CH﹣COONa,(1)反应①为丙烯的取代反应,所以反应类型是取代反应,所以答案是:取代反应;(2)反应④是与HCl加成,设计这一步反应的目的是保护分子中碳碳双键不被氧化,所以答案是:保护分子中碳碳双键不被氧化;(3)该反应方程式为2CH2═CH﹣CH2Cl ![]() ClCH2﹣CH═CH﹣CH2Cl+CH2═CH,
ClCH2﹣CH═CH﹣CH2Cl+CH2═CH,
所以答案是:2CH2═CH﹣CH2Cl ![]() ClCH2﹣CH═CH﹣CH2Cl+CH2═CH 2 , (4)通过以上分析知,E结构简式为
ClCH2﹣CH═CH﹣CH2Cl+CH2═CH 2 , (4)通过以上分析知,E结构简式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(5)有机化合物C有多种同分异构体,其中属于酯类且能发生银镜反应的所有同分异构体的结构简式为HCOOCH2CH2CH3、HCOOCH(CH3)2 ,
;(5)有机化合物C有多种同分异构体,其中属于酯类且能发生银镜反应的所有同分异构体的结构简式为HCOOCH2CH2CH3、HCOOCH(CH3)2 ,
所以答案是:HCOOCH2CH2CH3、HCOOCH(CH3)2 .