题目内容
合成气(CO和H2)是重要的化工原料,在工业生产中有着广泛的应用。
(1)工业上用甲烷和水蒸气在高温条件下发生反应制备合成气(CO和H2),4g甲烷完全反应吸收51.5KJ热量,写该反应的热化学方程式
(2)工业上常用合成气来冶炼金属,其中CO还原氧化铁来冶炼生铁方程式如下:
3CO(g)+Fe2O3(s) 3CO2(g)+ 2Fe(s) △H<0
3CO2(g)+ 2Fe(s) △H<0
①如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, 。
②在一个容积为4L的密闭容器中,1000℃时加入4mol CO(g)和足量Fe2O3(s),反应2分钟后达到平衡,测得此时容器内气体的密度为40g/L,求该时间范围内反应的平均反应速率υ(CO2)= ___、CO的平衡转化率= _____、该反应的化学平衡常数K= 。
(1)工业上用甲烷和水蒸气在高温条件下发生反应制备合成气(CO和H2),4g甲烷完全反应吸收51.5KJ热量,写该反应的热化学方程式
(2)工业上常用合成气来冶炼金属,其中CO还原氧化铁来冶炼生铁方程式如下:
3CO(g)+Fe2O3(s)
 3CO2(g)+ 2Fe(s) △H<0
3CO2(g)+ 2Fe(s) △H<0 ①如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, 。
| A.容器中Fe2O3的质量不随时间而变化 | B.反应物不再转化为生成物 |
| C.n (CO) :n (CO2) = 1:1 | D.容器中气体的压强不随时间而变化 |
(1)CH4(g)+H2O(g) =" CO" (g)+3H2 (g) △H=+206kJ?mol-1(2分)
(2)①A D(2分,少选、错选均为0分)
② 0.375 mol/(L?min)(2分)75% (1分) 27(2分)
(2)①A D(2分,少选、错选均为0分)
② 0.375 mol/(L?min)(2分)75% (1分) 27(2分)
试题分析::(1)4g甲烷完全反应吸收51.5KJ热量,16g甲烷和水反应吸收热量为206KJ;反应的热化学方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206KJ/mol;
(2)①A中容器中Fe2O3的质量不随时间而变化,说明反应达到平衡,故A符合;B中平衡时,正逆反应都进行只是正反应速率和逆反应速率相同,故B不符合;C中一氧化碳和二氧化碳的物质的量之比和起始量有关,n(CO):n(CO2)不一定为1:1,故C不符合;D在反应是气体体积不变的反应,平衡时容器中气体的压强不随时间而变化,故D正确;
② 3CO(g)+Fe2O3(s)═3CO2(g)+2Fe(s)
起始(mol) 4 0
变化(mol) x x
平衡(mol) 4-x x
容器内气体的密度为40g/L:
 =40g/L计算得到x=3mol;
=40g/L计算得到x=3mol;该时间范围内反应的平均反应速率υ(CO2)=
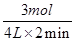 =0.375mol/L;
=0.375mol/L;CO的平衡转化率=
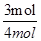 ×100%=75%
×100%=75%
练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案
相关题目




 CH3OH(g) ΔH1 ②CO2(g)+3H2(g)
CH3OH(g) ΔH1 ②CO2(g)+3H2(g)