题目内容
2.氯气是重要的化工原料,有广泛的用途.(1)氯气的电子式是
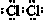 .
.(2)电解饱和食盐水制氯气的离子方程式是2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
(3)工业上用H2和Cl2反应制HCl,反应的能量变化如图所示:
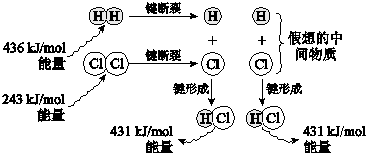
①该反应的热化学方程式是H2(g)+Cl2(g)=2HCl(g)△H=-183kJ/mol.
②实验室配制FeCl3溶液时,将FeCl3固体溶解在稀盐酸中,请结合离子方程式用平衡移动原理解释原因.溶液中存在Fe3++3H2O?Fe(OH)3+3H+平衡,增大H+浓度,平衡逆向移动,抑制FeCl3水解.
(4)“氯胺(NH2Cl)消毒法”是在用液氯处理自来水的同时通入少量氨气,发生反应:Cl2+NH3=NH2Cl+HCl.NH2Cl能与水反应生成可以杀菌消毒的物质,该反应中元素的化合价不变.
①NH2Cl与水反应的化学方程式是NH2Cl+H2O=NH3+HClO或NH2Cl+2H2O=NH3•H2O+HClO.
②在Cl2+NH3=NH2Cl+HCl中,每消耗11.2L Cl2(标准状况下),转移电子0.5 mol.
分析 (1)氯气分子中两个氯原子通过共用1对电子达到稳定结构;
(2)电解饱和食盐水生成氯化钠、氯气和氢气;
(3)①根据图中键能数据,应用“△H=反应物总键能-生成物总键能”即可求得反应热,注意热化学方程式需要注明物质状态;
②三价铁离子为弱碱阳离子,在水溶液中部分水解生成氢氧化铁和氢离子,结合盐类水解平衡移动影响因素解答;
(4)①根据题目信息“生成可以杀菌消毒的物质”可知一种产物为HClO,根据守恒的原则,另一种产物为NH3;
②计算产生氯气的物质的量,反应中只有Cl元素化合价发生变化,化合价分别由0价变化为-1价、+1价,据此解答.
解答 解;(1)氯气分子中两个氯原子通过共用1对电子达到稳定结构,电子式为: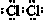
故答案为: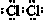
(2)电解饱和食盐水生成氯化钠、氯气和氢气,离子方程式:2Cl-+2H2O═2OH-+H2↑+Cl2↑;
故答案为;2Cl-+2H2O═2OH-+H2↑+Cl2↑;
(3)①△H=反应物总键能-生成物总键能”=436kJ/mol+243kJ/mol-2×431kJ/mol=-183kJ/mol,则热化学方程式为H2(g)+Cl2(g)=2HCl(g)△=-183kJ/mol,
故答案为:H2(g)+Cl2(g)=2HCl(g)△=-183kJ/mol;
②因为Fe3+存在水解平衡且水解后溶液显酸性,离子方程式为Fe3++3H2O?Fe(OH)3+3H+,所以通过增大H+浓度的方式抑制Fe3+水解,
故答案为:溶液中存在 Fe3++3H2O?Fe(OH)3+3H+平衡,增大H+浓度,平衡逆向移动,抑制FeCl3水解;
(4)①根据题目信息“生成可以杀菌消毒的物质”可知一种产物为HClO,根据守恒的原则,另一种产物为NH3,方程式为NH2Cl+H2O=HClO+NH3,
故答案为:NH2Cl+H2O=HClO+NH3; ②反应中只有氯元素化合价发生变化,氯气的物质的量为0.5mol,化合价分别由0价变化为-1价、+1价,则转移电子0.5mol,
故答案为:0.5.
点评 本题为综合题,考查了氯气的结构化学性质,涉及电子式的书写、离子方程式的书写、热化学方程式的书写、盐类水解的应用、氧化还原反应转移电子数目计算,题目难度不大,掌握基础是关键.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | Na2O2与水反应是水作还原剂的氧化还原反应 | |
| B. | 过氧化钠的电子式为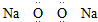 | |
| C. | 在过氧化钠与水的反应中,每生成0.1 mol氧气,转移电子的数目为0.4NA | |
| D. | 二氧化碳通过Na2O2粉末,反应后固体物质增重 |
| A. | 2.4g金属镁变成镁离子时失去的电子数为0.2NA | |
| B. | 常温常压下,1mol氦气所含原子数为2NA | |
| C. | 标准状况下,22.4L CCl4含有的氯原子数为4NA | |
| D. | 0.5mol•L-1 Na2CO3溶液中含有Na+离子的数目为NA |
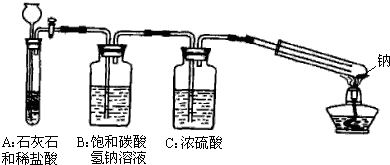
 下面是有关物质的转化关系图(部分产物已省略),其中A为单质,E在常温下为液体,D是一种气体,C的相对分子质量为78.请回答下列有关问题:
下面是有关物质的转化关系图(部分产物已省略),其中A为单质,E在常温下为液体,D是一种气体,C的相对分子质量为78.请回答下列有关问题: ;
;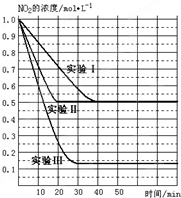 某条件下,在2L密闭容器中充入NO2发生如下反应:2NO2(g)?
某条件下,在2L密闭容器中充入NO2发生如下反应:2NO2(g)?