题目内容
下图为某市市售盐酸试剂瓶标签上的部分数据。通过计算回答:(1)在标准状况下,1体积水吸收多少体积的HCl气体可制得此盐酸?(水的密度以1.00 g·cm-3计)
(2)该盐酸25.4 mL与2.00 mol· L-1的NaOH溶液100 mL混合,再将混合后溶液稀释至1.00 L,此时溶液中氢离子的物质的量浓度约为多少?
盐酸 分子式:HCl 相对分子质量:36.5 外观:合格 密度:约为1.18 g·cm-3 HCl的质量分数:36.5% 符合GB622—89 |
(1)353 L
(2) 0.100 mol· L-1
解析:(1)

V(HCl)=353 L
(2)此盐酸的物质的量浓度为
c(HCl)=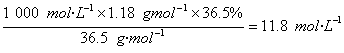
与NaOH溶液混合后溶液中的氢离子浓度为:
c(H+)=

练习册系列答案
相关题目
下图为实验室某浓盐酸试剂瓶的标签,试根据标签上的有关数据回答下列问题


