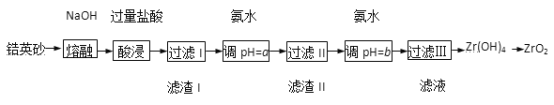
题目内容
【题目】I. 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。
某同学按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol·L-1的KBr溶液、KI(含淀粉)溶液、NaOH(含酚酞)溶液、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心e处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好。
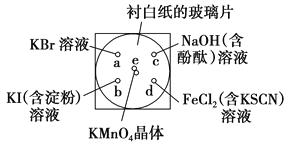
(1)e处反应的离子方程式为____________________________。
(2)b处的实验现象为_________________________________________。
(3)c处反应的化学方程式为____________________________________________。
标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为________mol。
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?________(填“能”或“不能”),若能,其氧化性由强到弱的顺序是________________。
II. 据报道,有一种细菌在有氧气存在的酸性溶液中,可将黄铜矿CuFeS2氧化成硫酸盐:4CuFeS2+2H2SO4+17O2===4CuSO4+2Fe2(SO4)3+2H2O。利用反应后的溶液,按如下流程可制备胆矾(CuSO4·5H2O):
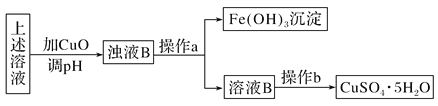
①检验溶液B中Fe3+是否被除尽的实验方法
_________________________________________________________________。
②在实验室中,设计两个原理不同的方案,从溶液B中提炼金属铜(要求:一种方案只用一个反应来完成)。写出两种方案中涉及的化学方程式:
方案一:_________________________________________________________;
方案二:_________________________________________________________。
【答案】 2MnO![]() +16H++10Cl-===2Mn2++5Cl2↑+8H2O 溶液由无色变为蓝色,溶液变为红色 Cl2+2NaOH===NaCl+NaClO+H2O 0.01 能 KMnO4>Cl2>FeCl3 取B中溶液少量于试管中,滴加少量KSCN溶液,若无红色出现,说明Fe3+已除尽 CuSO4+Fe===FeSO4+Cu 2CuSO4+2H2O
+16H++10Cl-===2Mn2++5Cl2↑+8H2O 溶液由无色变为蓝色,溶液变为红色 Cl2+2NaOH===NaCl+NaClO+H2O 0.01 能 KMnO4>Cl2>FeCl3 取B中溶液少量于试管中,滴加少量KSCN溶液,若无红色出现,说明Fe3+已除尽 CuSO4+Fe===FeSO4+Cu 2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
【解析】I.
(1)四处产生黄绿色气体,说明生成氯气.由于有氯化锰生成,根据原子守恒还生成水,反应方程式为:2KMnO4+16HCl(浓)═2MnCl2+2KCl+6Cl2↑+4H2O,离子方程式为2MnO4-+16H++10Cl-═2Mn2++6Cl2↑+4H2O。
(2)生成的氯气在a处与碘化钾反应,置换出碘,可观察到溶液由无色变为蓝色。
(3)氯气与氢氧化钠反应生成氯化钠和次氯酸钠,反应的方程式为Cl2+2NaOH═NaCl+NaClO+H2O,当有0.224L Cl2被NaOH溶液吸收后,即有0.01mol氯气被吸收,反应中Cl元素化合价由0价分别变化为-1价、+1价,则转移电子0.01mol。
(4)因反应2KMnO4+16HCl(浓)═2MnCl2+2KCl+6Cl2↑+4H2O,可知氧化性:KMnO4>Cl2,d处生成的氯气在d处与氯化亚铁反应,将亚铁离子氧化为铁离子,可知氧化性: Cl2>FeCl3 ,故氧化性:KMnO4>Cl2>FeCl3。
II.
①检验溶液B中Fe3+是否被除尽的试剂是KSCN溶液,加入KSCN溶液若变红证明含有铁离子,若加入后溶液不变红证明不含铁离子;
②硫酸铜溶液得到金属铜的方法,可以加入铁粉置换铜反应的化学方程式为:CuSO4+Fe=FeSO4+Cu;也可以惰性电极通电电解硫酸铜溶液,反应的化学方程式为: 2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4

【题目】下表中对应关系错误的是( )
A | NaCl===Na++Cl-; NH3·H2O | 均属于电离方程式 |
B | Ba2++SO42-===BaSO4↓; HCO3-+OH-===CO32-+H2O | 均可表示一类反应 |
C | SO2使酸性高锰酸钾溶液褪色;SO2使碱性酚酞溶液褪色 | 均利用SO2的同一性质 |
D | Cl2+2NaOH===NaCl+NaClO+H2O; 3S+6NaOH===2Na2S+Na2SO3+3H2O | Cl2和S在反应中既作氧化剂又作还原剂 |
A. A B. B C. C D. D