题目内容
短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是
| A.元素W 的简单气态氢化物的热稳定性比X 的强 |
| B.元素W 的最高价氧化物对应水化物的酸性比Z 的弱 |
| C.化合物YX、ZX2、WX3中化学键的类型相同 |
| D.原子半径的大小顺序: r(Y)>r(Z)>r(W) >r(X) |
D
解析试题分析:根据题意可得X是O;Y是Mg;Z是Si;W是S。A、O、S是同一主族的元素,由于非金属性O>S,元素的非金属性越强,其氢化物的稳定性就越强。所以元素W 的简单气态氢化物的热稳定性比X 的弱。错误。B、元素的非金属性S>Si。元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。所以元素W 的最高价氧化物对应水化物的酸性比Z 的强。错误。C.MgO是离子晶体,离子之间以离子键结合;SiO2是原子晶体,原子间以共价键结合;SO3是分子晶体,分子间以分子间作用力结合。在分子内原子间以共价键结合。所以这三种化合物的化学键不同。错误。D.Mg、Si、S都是第三周期的元素,原子序数越大,原子的半径就越小。而O是第二周期的元素对于不同周期的元素来说,原子核外电子层数越多,原子半径就越大。所以原子半径Mg>Si>S> O 。正确。
考点:考查元素的推断、元素及相应的化合物的性质的知识。

两种粒子的质子数、电子数分别相等,它们不可能是
| A.两种离子 | B.一种原子和一种分子 |
| C.一种分子和一种离子 | D.一种单质分子和一种化合物分子 |
有4组同一族元素所形成的不同物质,在101kPa时测定它们的沸点(℃)如表所示,则下列各项判断正确的是( )
| 第一组 | He -268.8 | (a) -249.5 | Ar -185.8 | Kr -151.7 |
| 第二组 | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 184.0 |
| 第三组 | (c) 19.4 | HCl -84.0 | HBr -67.0 | HI -35.3 |
| 第四组 | H2O 100.0 | H2S -60.2 | (d) -42.0 | H2Te -1.8 |
B.第三组与第四组相比较,化合物的稳定顺序为:HBr<d
C.第三组物质溶于水后,溶液的酸性c最强
D.第四组物质中H2O的沸点最高,是因为H2O分子间存在氢键
国外科学家曾将铅(Pb)和氪(Kr)两种元素的原子核对撞,获得了一种质子数为118、
质量数为293的新元素,该元素原子核内的中子数和核外电子数之差为
| A.47 | B.57 | C.61 | D.175 |
对于元素周期表, 下列叙述中不正确的是( )
| A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 |
| B.在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 |
| C.在金属元素区域可以寻找制备新型农药材料的元素 |
| D.元素周期表是元素周期律的具体表现形式 |
下列各基态原子或离子的电子排布式正确的是
| A.O2-1s22s22p4 | B.Ca [Ar]3d2 |
| C.Fe [Ar]3d54s3 | D.Si 1s22s22p63s23p2 |
a、b、c、d、e为元素周期表前3周期中的部分元素,它们在元素周期表中的相对位置如图所示。下列叙述正确的是( )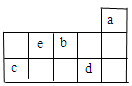
| A.b元素除0价外,只有一种化合价 |
| B.五种元素中,c元素的单质性质最稳定 |
| C.d气态氢化物的水溶液既有氧化性也有还原性 |
| D.e元素最高价氧化物对应的水化物是一种强酸,保存在无色试剂瓶里 |
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可使湿润的红色石蕊试纸变蓝,由此可知( )
| A.X、Y、Z中最简单氢化物稳定性最弱的是Y |
| B.Z元素氧化物对应水化物的酸性一定强于Y |
| C.X元素形成的单核阴离子还原性强于Y |
| D.Z元素单质在化学反应中只表现氧化性 |
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
| | R | |
| X | T | Z |
| | Q | |
A.非金属性:Z<T<X
B.R与Q的电子数相差26
C.气态氢化物稳定性:R <T<Q
D.最高价氧化物的水化物的酸性:T>Q