题目内容
【题目】金属及其化合物的种类很多,我们可以按照“金属单质、金属氧化物、金属氢氧化物、盐”的类别进行究. 以下是元素周期表中前18号某种金属元素对应的单质及其化合物之间的转化关系(“→”所指的转化都是一步完成). 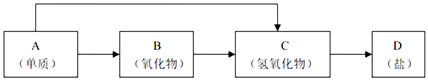
(1)A与水反应的离子方程式: .
(2)若B为呼吸面具中的供养剂,其供养时每生成1mol O2 , 反应过程中转移的电子数为 .
(3)200℃时,11.6g CO2和 H2O 的混合物气体与足量的B反应,反应后固体增加了3.6g,则原混合物的平均相对分子质量为 .
(4)写出一种“C→D”转化的离子方程式: .
(5)某同学将一小块A单质露置于空气中,观察到下列现象:
银白色 ![]() 变灰暗
变灰暗 ![]() 变白色
变白色 ![]() 出现液滴
出现液滴 ![]() 白色固体
白色固体
则下列说法正确的是
A.①发生了氧化还原反应
B.①变灰暗色是因为生成了过氧化钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液
D.④只发生物理变化.
【答案】
(1)2Na+2H2O=2Na++2OH﹣+H2↑
(2)2NA
(3)23.2
(4)OH﹣+H+=H2O
(5)A
【解析】解:金属单质可以形成氧化物,也可以直接生成氢氧化物碱、金属氧化物可以形成碱、金属氢氧化物一步形成盐,解题关键在金属单质可以直接形成碱的推断.A为活泼金属K、Ca、Na、Mg等;各步反应都需要一步形成;(1)A为钠,与水反应的化学方程式为:2Na+2H2O=2Na++2OH﹣+H2↑,所以答案是:2Na+2H2O=2Na++2OH﹣+H2↑;(2)若B为呼吸面具中的供养剂,其供养时主要反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2↑,其供养时每生成1mol O2 , 反应过程中转移的电子数为2NA ,
所以答案是:2NA;(3)由反应:2Na2O2+2CO2=2Na2CO3+O2 , 2Na2O2+2H2O=4NaOH+O2↑,可知参加反应的CO2和H2O与生成O2的物质的量之比为2:1,m(增重)=m(吸收)﹣m(放出),即11.6g﹣m(O2)=3.6g,m(O2)=11.6g﹣3.6g=8.0g,
所以n(O2)= ![]() =0.25mol,n(CO2和H2O)=0.5mol,
=0.25mol,n(CO2和H2O)=0.5mol,
则原混合气体的平均摩尔质量为 ![]() =23.2g/mol,
=23.2g/mol,
原混合物的平均式量为23.2,
所以答案是:23.2;(4)C→D转化的化学方程式为:NaOH+HCl=NaCl+H2O,离子方程式为:OH﹣+H+=H2O,
所以答案是:OH﹣+H+=H2O;(5)Na的性质活泼,易与空气中氧气反应生成Na2O,Na2O易与水反应生成NaOH,NaOH吸收空气中的水和CO2生成Na2CO3xH2O,Na2CO3xH2O风化脱水生成Na2CO3 ,
A、①发生氧化还原反应生成了氧化钠,故A正确;
B、②变白色主要是因为生成了氢氧化钠,Na2O+H2O=2NaOH,故B错误;
C、③是氢氧化钠潮解,吸收水蒸气形成氢氧化钠溶液,故C错误;
D、④是二氧化碳和氢氧化钠反应生成碳酸钠固体,发生了化学反应,故D错误;
所以答案是:A.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选甲基橙作指示剂。
(1)盛装0.2000 mol/L盐酸标准液应该用______式滴定管。(填“酸”或“碱”)
(2)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视________________。直到加入一滴盐酸后,溶液由_______________________________,即到终点。
(3)滴定操作可分解为如下几步:
①检查滴定管是否漏水;②取一定体积的待测液于锥形瓶中;
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管;
④装标准溶液和待测液并调整液面(记录初读数);
⑤用蒸馏水洗涤玻璃仪器;⑥滴定操作
正确的操作顺序为:______________________。
(4)有关数据记录如下:
实验序号 | 待测定液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.60 | 20.70 |
2 | 20.00 | 6.00 | 25.90 |
3 | 20.00 | 1.40 | 23.20 |
则NaOH溶液的物质的量浓度为______mol/L。
(5)若滴定时锥形瓶未干燥,则测定结果________;若滴定前平视读数,滴定终点时仰视读数,则所测碱的浓度值________。(填“无影响”、“偏高”或“偏低”)。