题目内容
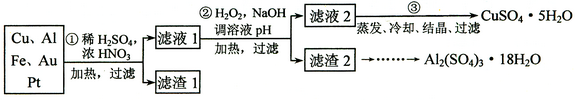
(12分)某探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
请回答下列问题:
⑴第①步Cu与酸反应的离子方程式______________ 。
⑵第②步加H2O2的作用是_______________;调溶液pH的目的是使____________生成沉淀。
⑶用第③步所得CuSO4·5H2O制备无水CuSO4的方法是______________。
⑷由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
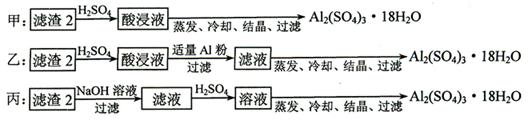
上述三种方案中,_______方案不可行,原因是_____________________________;
从原子利用率角度考虑,___________方案更合理。
⑸探究小组用滴定法测定CuSO4·5H2O含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol /L EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如下:Cu2+ + H2Y2-= CuY2- + 2H+
写出计算CuSO4·5H2O质量分数的表达式ω= _____________________________ ;
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子

请回答下列问题:
⑴第①步Cu与酸反应的离子方程式______________ 。
⑵第②步加H2O2的作用是_______________;调溶液pH的目的是使____________生成沉淀。
⑶用第③步所得CuSO4·5H2O制备无水CuSO4的方法是______________。
⑷由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:

上述三种方案中,_______方案不可行,原因是_____________________________;
从原子利用率角度考虑,___________方案更合理。
⑸探究小组用滴定法测定CuSO4·5H2O含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol /L EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如下:Cu2+ + H2Y2-= CuY2- + 2H+
写出计算CuSO4·5H2O质量分数的表达式ω= _____________________________ ;
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
(12分)答案:⑴ Cu + 4H+ + 2NO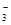
 Cu2+ + 2NO2↑+ 2H2O 或3Cu + 8H+ + 2NO
Cu2+ + 2NO2↑+ 2H2O 或3Cu + 8H+ + 2NO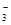
 3Cu2+ + 2NO↑+ 4H2O (2分)
3Cu2+ + 2NO↑+ 4H2O (2分)
⑵将Fe2+氧化为Fe3+ Fe3+、Al3+
⑶加热脱水
⑷甲 所得产品中含有较多Fe2(SO4)3杂质 乙
⑸ × 100% (2分) c (2分)
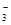
 Cu2+ + 2NO2↑+ 2H2O 或3Cu + 8H+ + 2NO
Cu2+ + 2NO2↑+ 2H2O 或3Cu + 8H+ + 2NO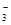
 3Cu2+ + 2NO↑+ 4H2O (2分)
3Cu2+ + 2NO↑+ 4H2O (2分)⑵将Fe2+氧化为Fe3+ Fe3+、Al3+
⑶加热脱水
⑷甲 所得产品中含有较多Fe2(SO4)3杂质 乙
⑸ × 100% (2分) c (2分)
将金属混合物处理时,(1)铜和浓硝酸、稀硫酸的混合酸:
开始发生:Cu+2NO3-+4H+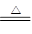 Cu2++2NO2↑+2H2O,
Cu2++2NO2↑+2H2O,
最后发生:3Cu+2NO3-+8H+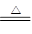 3Cu2++2NO↑+4H2O;金属混合物中只有Au和Pt不溶于硝酸,其是滤渣的主要成分;
3Cu2++2NO↑+4H2O;金属混合物中只有Au和Pt不溶于硝酸,其是滤渣的主要成分;
(2)第②步加入过氧化氢的目的是将Fe2+氧化为Fe3+;过氧化氢氧化亚铁离子时生成的是铁离子和水,不引入杂质,对环境无污染;调整pH值,使溶液中的Fe3+、Al3+转化为沉淀;
(3)用第③步中所得的五水硫酸铜制取无水硫酸铜的方法是加热脱水;
(4)滤渣2的主要成分是氢氧化铁和氢氧化铝,以此为基础分析该探究小组设计的三种方法,其中方案甲中制得产品中一定含有较多的Fe2(SO4)3杂质;方案乙和丙中,从原子利用的角度考虑,乙方案最合理;
(5)根据探究小组的方案,可知计算五水硫酸铜质量分数的表达式为:
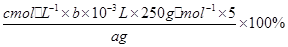 ;
;
滴定过程中,未干燥锥形瓶,对结果无影响,排除a;滴定终点时滴定管尖嘴中产生气泡,造成消耗EDTA的读数偏小,测定结果偏低,排除b;未除净干扰离子,造成EDTA消耗偏多,测定结果偏高,选c。
开始发生:Cu+2NO3-+4H+
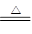 Cu2++2NO2↑+2H2O,
Cu2++2NO2↑+2H2O,最后发生:3Cu+2NO3-+8H+
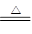 3Cu2++2NO↑+4H2O;金属混合物中只有Au和Pt不溶于硝酸,其是滤渣的主要成分;
3Cu2++2NO↑+4H2O;金属混合物中只有Au和Pt不溶于硝酸,其是滤渣的主要成分;(2)第②步加入过氧化氢的目的是将Fe2+氧化为Fe3+;过氧化氢氧化亚铁离子时生成的是铁离子和水,不引入杂质,对环境无污染;调整pH值,使溶液中的Fe3+、Al3+转化为沉淀;
(3)用第③步中所得的五水硫酸铜制取无水硫酸铜的方法是加热脱水;
(4)滤渣2的主要成分是氢氧化铁和氢氧化铝,以此为基础分析该探究小组设计的三种方法,其中方案甲中制得产品中一定含有较多的Fe2(SO4)3杂质;方案乙和丙中,从原子利用的角度考虑,乙方案最合理;
(5)根据探究小组的方案,可知计算五水硫酸铜质量分数的表达式为:
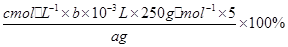 ;
;滴定过程中,未干燥锥形瓶,对结果无影响,排除a;滴定终点时滴定管尖嘴中产生气泡,造成消耗EDTA的读数偏小,测定结果偏低,排除b;未除净干扰离子,造成EDTA消耗偏多,测定结果偏高,选c。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目