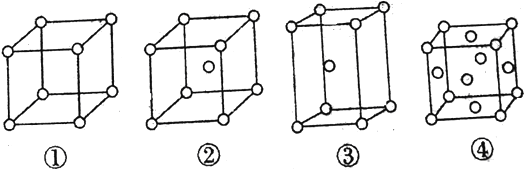
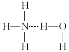题目内容
【题目】把Na2CO3和NaHCO3的混合物27.4g加热到质量不再变化时,得残留固体21.2 g。求原混合物中Na2CO3和NaHCO3的物质的量之比为
A. 2:1 B. 1:2
C. 1:4 D. 4:1
【答案】B
【解析】
加热时发生反应方程式为:2NaHCO3![]() Na2CO3+CO2↑+H2O,根据题干数据计算出反应前后固体质量的变化,然后根据差量法计算出碳酸氢钠的质量,再计算出碳酸钠的质量,最后根据n=m÷M计算出二者的物质的量之比。
Na2CO3+CO2↑+H2O,根据题干数据计算出反应前后固体质量的变化,然后根据差量法计算出碳酸氢钠的质量,再计算出碳酸钠的质量,最后根据n=m÷M计算出二者的物质的量之比。
设NaHCO3的物质的量为x,则根据方程式可知
2NaHCO3![]() Na2CO3+CO2↑+H2O △m
Na2CO3+CO2↑+H2O △m
2mol 62g
x (27.4-21.2)g=6.2g
x=2mol×6.2g/62g=0.2mol
混合物中碳酸氢钠的质量为:0.2mol×84g/mol=16.8g,混合物中碳酸钠的质量是27.4g-16.8g=10.6g,物质的量为10.6g÷106g/mol=0.1mol,所以原混合物中Na2CO3与NaHCO3的物质的量之比为:0.1mol:0.2mol=1:2,答案选B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |