题目内容
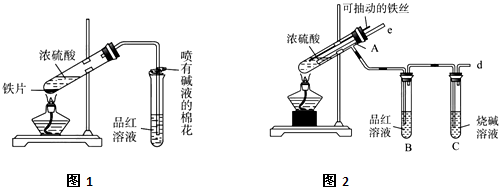
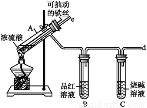
为探究铁与浓硫酸在加热条件下的反应,某活动小组设计并完成以下实验:
(1)实验目的:分析铁与浓硫酸在加热条件下的反应.
①洗气瓶中浓硫酸的作用是________.
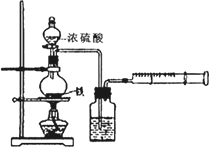
②写出加热条件下铁与浓硫酸反应生成SO2的化学方程式________.
活动小组预测随着反应的进行,硫酸的浓度降低,可能还会有氢气产生,为进一步确认气体的成分还需要进行进一步的实验.
(2)实验目的:检验气体的成分.
试剂:氢氧化钠溶液、浓硫酸、氧化铜粉末、无水硫酸铜固体、品红溶液、高锰酸钾酸性溶液、碱石灰.
仪器如下图(可重复使用,可根据需要取用);
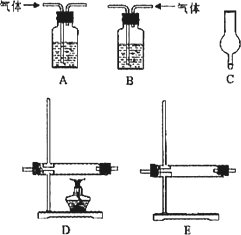
①连接仪器.将装置的字母填入□内,并将试剂名称填写在相应的括号内(可不填满)
②若混合气体中含有氢气,实验过程中能观察到的现象是________.
(3)实验目的:确定产物的含量.
①若混合气体中含有SO2和H2,为测定混合气体中各成分含量,需收集的数据有________.
②若反应后烧瓶中溶液含有的金属阳离子有Fe2+、Fe3+,其中检验是否含有Fe2+可采用的试剂为________;如果该过程中共消耗了11.2 g铁,反应后的溶液能吸收标准状况下1.12 L氯气,则原溶液中含有Fe3+的物质的量为________mol.
解析:
|
(1)①干燥气体 ②2Fe+6H2SO4(浓) (2)①A-A-A(或C)-D-E-A(或C)或A-A-A-A(或C)-D-E-A(或C)(合理给分) 品红溶液——高锰酸钾酸性溶液-浓硫酸(或石灰)-氧化铜粉末-无水硫酸铜固体-浓硫酸碱石灰 或:品红溶液-高锰酸钾酸性溶液-高猛酸钾酸性溶液(或品红)-浓硫酸(或碱石灰)-氧化铜粉末-无水硫酸铜固体-浓硫酸或碱石灰 或:品红溶液-氢氧化钠溶液-高猛酸钾酸性溶液(或品红)-浓硫酸(或碱石灰)-氧化铜粉末-无水硫酸铜固体-浓硫酸或碱石灰 ②D中固体粉末由黑色变为红色,E中固体由白色变为蓝色 (3)①混合气体的总体积、反应前后D中粉末质量的差值(反应前D中氧化铜粉末质量反应后D中粉末的质量)(其他合理给分) ②酸性高锰酸钾溶液、0.1 |

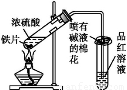
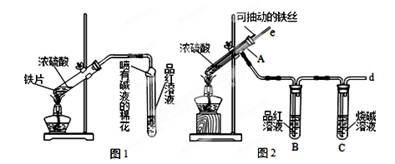
(12分)某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。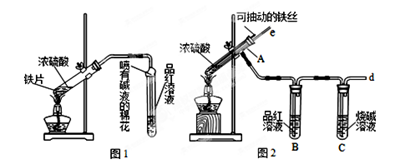
(1)比较两实验装置,图2装置的优点是:
①能更好的吸收有毒气体SO2,防止其污染环境;
② 。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而防止污染环境;二是 。
(3)反应一段时间后,用滴管吸取A试管中的溶液滴入适量水中为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为验证Ⅲ的可能性,选用如下试剂,填写下列空格:
| A.稀HCl溶液 | B.稀H2SO4硫酸 | C.KSCN溶液 | D.KMnO4溶液 |
验证Ⅲ:步骤1. 取试样,滴加少量的 (填试剂序号),溶液的颜色变 色, 则试样中含有Fe3+。
步骤2. 再取适量的试样滴加到少量的 (填试剂序号),观察到的现象为 , 则试样中含有Fe2+。