题目内容
【题目】按要求回答下列问题:
(1)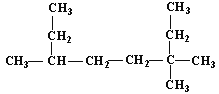 的名称为___;
的名称为___;
(2)A的化学式为C4H9Cl,已知A的核磁共振氢谱表明其只有一种化学环境的氢;则A的名称为___。
(3)2,4-二氯甲苯的结构简式为___;
(4)某物质结构如图所示,碳原子数为___;该物质可以与下列___(填序号)发生反应。
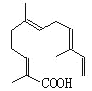
A.KMnO4酸性溶液 B.氢气 C.溴水 D.NaOH溶液
(5)有机物A的结构简式为:![]() ,A在酸性条件下水解生成的芳香族化合物有多种同分异构体,请写出其中含有苯环(不含其它环状结构)、且能发生水解反应和银镜反应的同分异构体中核磁共振氢谱有五组峰的结构简式___。
,A在酸性条件下水解生成的芳香族化合物有多种同分异构体,请写出其中含有苯环(不含其它环状结构)、且能发生水解反应和银镜反应的同分异构体中核磁共振氢谱有五组峰的结构简式___。
【答案】3,3,6—三甲基辛烷 2—甲基—2—氯丙烷 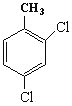 15 ABCD 、
15 ABCD 、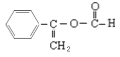 、
、![]()
【解析】
(1)该有机物为烷烃,选取最长碳链为主链,然后从取代基编号之和最小的一端编号,先写出取代基位置,再写出主链名称;
(2)A的核磁共振氢谱表明只有一种化学环境的氢,说明含有3个甲基,其结构简式为(CH3)3CCl;
(3)甲基连接的碳为1号C,在2、4号C各含有1个氯原子;
(4)根据图示的有机物结构简式判断含有碳原子数;根据该有机物结构判断具有的化学性质;
(5)![]() 在酸性条件下水解C6H5CH=CHCOOH,C6H5CH=CHCOOH的同分异构体满足:含有苯环、能发生水解反应和银镜反应,应为甲酸形成的酯基,侧链含有-OOCH结构,且核磁共振氢谱有五组峰,据此书写结构简式。
在酸性条件下水解C6H5CH=CHCOOH,C6H5CH=CHCOOH的同分异构体满足:含有苯环、能发生水解反应和银镜反应,应为甲酸形成的酯基,侧链含有-OOCH结构,且核磁共振氢谱有五组峰,据此书写结构简式。
(1)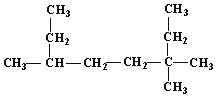 ,该有机物分子中最长碳链含有8个C,主链为辛烷,从右上方开始编号,在3号C含有2个甲基、6号C含有1个甲基,该有机物名称为3,3,6三甲基辛烷;
,该有机物分子中最长碳链含有8个C,主链为辛烷,从右上方开始编号,在3号C含有2个甲基、6号C含有1个甲基,该有机物名称为3,3,6三甲基辛烷;
答案为3,3,6三甲基辛烷。
(2)A的分子式为C4H9Cl,核磁共振氢谱表明只有一种化学环境的氢,说明含有3个甲基,所以A的结构简式为(CH3)3CCl,其名称为2甲基2氯丙烷;
答案为2甲基2氯丙烷。
(3)2,4二氯甲苯的主链为甲苯,甲苯所在的C为1号C,在2、4号C各含有1个氯原子,该有机物结构简式为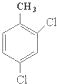 ,
,
答案为 。
。
(4)根据该有机物的结构简式可知,其分子中含有15个C;该有机物含有碳碳双键,能够被酸性高锰酸钾溶液氧化,能够与氢气发生加成反应,能够使溴水褪色;分子中还含有羧基,能够与NaOH溶液发生中和反应,所以ABCD都正确。
答案为15;ABCD。
(5)![]() 在酸性条件下水解生成C6H5CH=CHCOOH,C6H5CH=CHCOOH有多种同分异构体,其中含有苯环、能发生水解反应和银镜反应,应为甲酸形成的酯,其侧链含有OOCH结构, 核磁共振氢谱有五组峰,符合条件的结构简式有:
在酸性条件下水解生成C6H5CH=CHCOOH,C6H5CH=CHCOOH有多种同分异构体,其中含有苯环、能发生水解反应和银镜反应,应为甲酸形成的酯,其侧链含有OOCH结构, 核磁共振氢谱有五组峰,符合条件的结构简式有: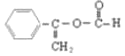 (五种氢)、
(五种氢)、![]() (五种氢);
(五种氢);
答案为 、
、![]() 。
。

【题目】某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1NaOH溶液
(1)若实验中大约要使用470 mL NaOH溶液,至少需要称量NaOH固体____g。
(2)从图中选择称量NaOH固体所需要的仪器是(填字母):____。
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
| |
序号 | a | b | c | d | e | f |
Ⅱ.测定中和热
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、盐酸、NaOH溶液,尚缺少的实验玻璃用品是____。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ___ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热ΔH=______(取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母)____。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【题目】已知T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表.
元素 | 相关信息 |
T | T元素可形成自然界硬度最大的单质 |
W | W与T同周期,核外有一个未成对电子 |
X | X原子的第一电离能至第四电离能分别是:I1=578kJ·mol-1,I2=1817kJ·mol-1,I3=2745kJ·mol-1,I4=11575kJ·mol-1 |
Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
Z | Z的一种同位素的质量数为63,中子数为34 |
(1)TY2是一种常用的溶剂,是__(填“极性分子”或“非极性分子”),分子中存在 ___个![]() 键。W的最简单氢化物容易液化,理由是___。
键。W的最简单氢化物容易液化,理由是___。
(2)在25℃、101kPa下,已知13.5g的X固体单质在O2中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式为__。
(3)基态Y原子中,电子占据的最高能层符号为__;该能层具有的原子轨道数为___、电子数为___,Y、氧、W元素的电负性由大到小的顺序为___(用元素符号作答)。
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00g·cm-3,则晶胞边长为___;
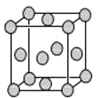
ZYO4常作电镀液,其中YO42-的空间构型是__,其中Y原子的杂化轨道类型是___,Z的单质与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2=ZCl+HO2,HO2(超氧酸![]() 不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是__。
不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是__。
A.O2是氧化剂 B.HO2是氧化产物
C.HO2在碱中能稳定存在 D.1molZ参加反应有1mol电子发生转移