题目内容
【题目】氢气是一种理想的“绿色能源”,下图为氢能产生与利用的途径:

(1) 氢气是一种________(选填“可再生”或“不可再生”)能源。上图中 4 个过程中能量转化形式有_______。
A 2 种 B 3 种 C 4 种 D 4 种以上
(2) 电解过程要消耗大量电能,而使用微生物作催化剂在阳光下即可分解
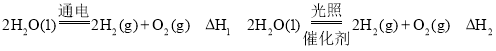
①以上反应的△H1_____△H2 (选填“>”、“<”或“=”)。
②电解水一段时间后,若阴极析出 224 mL(标准状况下)气体,则电路在通过的电子_____mol。
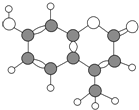
(3)已知 H2O(l)= H2O(g) △H= +44 kJ/mol,依据右图能量变化写出氢气燃烧生成液态水的热化学方程式_____,若 4 g 氢气燃烧生成液态水时放出的热量是_____kJ。
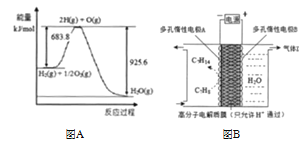
(4) 氢能利用需要选择合适的储氢材料。一定条件下,如图 B 所示装置可实现有机物的电化学储氢,总反应:2C7H8+ H2O(l)![]() 2C7H14 + 3O2(g)电解过程中产生的气体 X 为____。
2C7H14 + 3O2(g)电解过程中产生的气体 X 为____。
【答案】可再生 D = 0.02 2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1 571.6 O2
【解析】
(1)根据图示分析解答;
(2)①焓变只有反应物和生成物总能量的大小有关;
②电解水时,阴极产生氢气,根据得失电子计算;
(3)根据盖斯定律书写热化学方程式及计算;
(4)该实验的目的是储氢,根据反应总反应,得出电解过程中产生的气体X为O2;
(1)氢气是一种可再生资源;由如图1中4个过程,则能量转化形式有太阳能转化成电能,电能与化学能之间的转化,化学能转化成热能,光能等,所以4个过程中能量转化形式有4种以上,故答案选D;
(2)①因为焓变只与反应物和生成物的状态及其系数有关,所以2H2O(1)![]() 2H2(g)+O2(g)△H1 ,2H2O(1)
2H2(g)+O2(g)△H1 ,2H2O(1)![]() 2H2(g)+O2(g)△H2,反应物生成物完全相同,所以△H1=△H2;
2H2(g)+O2(g)△H2,反应物生成物完全相同,所以△H1=△H2;
②电解水时2H2O(1)![]() 2H2(g)+O2(g),阴极产生氢气,产生2mol氢气转移4mol电子,若阴极析出 224 mL(标准状况下)氢气即
2H2(g)+O2(g),阴极产生氢气,产生2mol氢气转移4mol电子,若阴极析出 224 mL(标准状况下)氢气即![]() =0.01mol,则电路在通过的电子0.02mol;
=0.01mol,则电路在通过的电子0.02mol;
(3)由图象可知①H2(g)+![]() O2(g)=H2O(g)△H=(683.8-925.6) kJmol-1=-241.8kJmol-1,已知②H2O(l)=H2O(g)△H=+44kJmol-1,利用盖斯定律将①×2-②×2可知2H2(g)+O2(g)═2H2O(l)△H=-571.6kJmol-1;4 g 氢气即
O2(g)=H2O(g)△H=(683.8-925.6) kJmol-1=-241.8kJmol-1,已知②H2O(l)=H2O(g)△H=+44kJmol-1,利用盖斯定律将①×2-②×2可知2H2(g)+O2(g)═2H2O(l)△H=-571.6kJmol-1;4 g 氢气即![]() =2mol,根据热化学反应方程式,燃烧生成液态水时放出的热量是571.6kJ;
=2mol,根据热化学反应方程式,燃烧生成液态水时放出的热量是571.6kJ;
(4)该实验的目的是储氢,根据反应总反应,得出电解过程中产生的气体X为O2。

【题目】为提纯下列物质![]() 括号内物质为杂质
括号内物质为杂质![]() ,所选用的试剂和分离方法都正确的是( )
,所选用的试剂和分离方法都正确的是( )
选项 | 物质 | 除杂试剂 | 分离方法或操作 |
A | 乙醇 | 无水 | 充分反应后蒸馏 |
B | 苯 | NaOH溶液 | 振荡静置后过滤 |
C | NaCl固体 | 水 | 高温溶解、降温结晶 |
D |
| 饱和 | 充分浸泡后过滤 |
A.AB.BC.CD.D