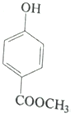
题目内容
17.下列实验操作合理的是( )| A. | 可以采取分液的方法分离甘油和水 | |
| B. | 分离苯和硝基苯时可以采取蒸馏的方法 | |
| C. | 采取冷却结晶的方法可以将食盐水中的氯化钠分离出来 | |
| D. | 重结晶是物质分离提纯过程中常用的方法,结晶次数越多,得到产品越纯净,所以通常操作时冷却结晶次数越多越好 |
分析 A.甘油与水互溶;
B.苯和硝基苯互溶,但沸点不同;
C.NaCl极易溶于水,在水中溶解度较大;
D.用溶解度受温度影响的差异分离可溶性固体,选择重结晶,结晶次数不能过多.
解答 解:A.甘油与水互溶,则不能分液分离,应选蒸馏法,故A错误;
B.苯和硝基苯互溶,但沸点不同,则可以采取蒸馏的方法分离,故B正确;
C.NaCl极易溶于水,在水中溶解度较大结晶,则利用蒸发将食盐水中的氯化钠分离出来,故C错误;
D.利用溶解度受温度影响的差异分离可溶性固体,冷却结晶次数越多,杂质含量反而越多,则得到产品越不纯净,故D错误;
故选B.
点评 本题考查混合物的分离提纯,为高频考点,把握发生的反应、物质的性质、混合物分离提纯等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案
相关题目
7. 五种短周期元素的部分性质数据如下:
五种短周期元素的部分性质数据如下:
(1)Y元素简单阴离子的结构示意图为 .
.
(2)关于Y、Z两种元素,下列叙述正确的是b(填序号).
a.简单离子的半径:Y>Z
b.气态氢化物的稳定性Y比Z强
c.最高价氧化物对应的水化物的酸性Z比Y强
(3)甲是由T、X两种元素形成的10e-分子,乙是由Y、W两种元素形成的化合物.某同学设计了如图所示装置(夹持仪器省)进行实验,将甲的浓溶液滴加到NaOH固体中,烧瓶中即有甲放出,一段时间后,观察到试管中的现象是白色沉淀生成,发生反应的离子方式是Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(4)XO2是导致光化学烟雾的“罪魁祸首”之一,其被氢氧化钠溶液吸收的化学方程式是:2XO2+2NaOH=M+NaXO3+H2O(已配平),产物M中元素X的化合价为+3.
 五种短周期元素的部分性质数据如下:
五种短周期元素的部分性质数据如下:| 元素代号 | T | X | Y | Z | W |
| 原子半径 (nm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
| 最高或最低化合价 | +1 | +5,-3 | +7,-1 | +6,-2 | +3 |
 .
.(2)关于Y、Z两种元素,下列叙述正确的是b(填序号).
a.简单离子的半径:Y>Z
b.气态氢化物的稳定性Y比Z强
c.最高价氧化物对应的水化物的酸性Z比Y强
(3)甲是由T、X两种元素形成的10e-分子,乙是由Y、W两种元素形成的化合物.某同学设计了如图所示装置(夹持仪器省)进行实验,将甲的浓溶液滴加到NaOH固体中,烧瓶中即有甲放出,一段时间后,观察到试管中的现象是白色沉淀生成,发生反应的离子方式是Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(4)XO2是导致光化学烟雾的“罪魁祸首”之一,其被氢氧化钠溶液吸收的化学方程式是:2XO2+2NaOH=M+NaXO3+H2O(已配平),产物M中元素X的化合价为+3.
2.下列说法正确的是( )
| A. | 溴乙烷中碳溴键极性较强,在碱的水溶液中易发生取代反应 | |
| B. | 乙醇分子中碳氧键键能比碳碳键键能小,所以易断裂而发生化学反应 | |
| C. | 甲醛常温下为无色无味液体,其水溶液即福尔马林 | |
| D. | 醋酸又称为冰醋酸,在浓硫酸条件下可以断裂氧氢键和乙醇发生酯化反应 |
6.维生素P的结构简式如图,从所含官能团看,它不具有下列哪一类化合物的性质( )


| A. | 酯 | B. | 酚 | C. | 醇 | D. | 醚 |

 ,取代反应反应
,取代反应反应