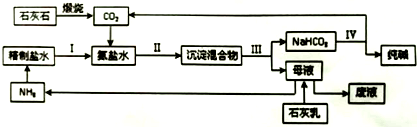
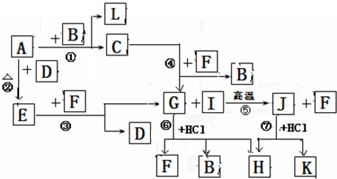
题目内容
4.用NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 2.0g H218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下,60g丙醇中存在的共价键总数为10NA | |
| C. | 1 molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| D. | 标准状况下,2.24L三氯甲烷中含有C-Cl键数目为0.3NA |
分析 A.H218O与D2O每个分子都含有10个中子,摩尔质量都为20g/mol;
B.每个丙醇分子中含有11个共价键;
C.不符合反应客观事实;
D.气体摩尔体积使用对象为气体;
解答 解:A.H218O与D2O每个分子都含有10个中子,摩尔质量都为20g/mol,2.0g H218O与D2O的混合物物质的量为0.1mol,含有中子数为NA,故A正确;
B.n(CH3CH2CH2OH)=$\frac{60g}{60g/mol}$=1mol,每个丙醇分子中含有11个共价键,则60g丙醇中存在的共价键的物质的量为11mol,总数为11NA,故B错误;
C.铜与浓硫酸反应生成产物为二氧化硫,故C错误;
D.标况下三氯甲烷为液体,不能使用气体摩尔体积,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的有关计算,把握丙醇的结构、铜与浓硫酸反应实质,熟悉气体摩尔体积使用条件和对象是解题关键,题目难度不大.

练习册系列答案
相关题目
15.在下列各溶液中,离子一定能大量共存的是( )
| A. | 室温下,pH=1的溶液中:Na+、Fe2+、NO3-、SO42- | |
| B. | 含有0.1mol•L-1Fe3+的溶液中:K+、Mg2+、I-、NO3- | |
| C. | 无色溶液中:K+、Na+、MnO4-、SO42- | |
| D. | pH=11的溶液中:CO32-、Na+、AlO2-、NO3- |
12.下列有关双氧水说法错误的是( )
| A. | H2O2、Na2O2都属于过氧化物,都存在非极性共价键 | |
| B. | 1mol H2O2在参加反应时可能转移lmol或2mol电子 | |
| C. | H2O2在酶作用下催化分解,随着温度的升高,分解速率持续加快 | |
| D. | H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似、与SO2不同 |
19.把炭和氧化铜组成的混合物隔绝空气加热,充分反应后称量所得剩余固体的质量为112g,向此剩余固体中加入200g稀硫酸,稀硫酸恰好被完全反应,过滤后所得滤渣呈红色.同时将反应所得的气体全部通入含溶质37g的澄清石灰水中,得到沉淀25g.下列有关说法正确的是( )
| A. | 生成气体的质量可能是11克或33克 | |
| B. | 滤渣中的红色物质可能是32克或96克 | |
| C. | 参与反应的氧化铜质量可能是40克或120克 | |
| D. | 稀硫酸的溶质质量可能是38.4克或115.2克 |
16.下列实验误差分析错误的是( )
| A. | 用湿润的pH试纸测稀碱液的,测定值偏小 | |
| B. | 用量筒量取10mLNaOH 溶液时,俯视刻度.量出的体积大于10mL | |
| C. | 使用天平称量时不小心将药品与砝码的位置放反了,称最结果可能是准确的 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小 |
 如图是一个实验室制取氯气并以氯气为原料进行特定反应的装置.
如图是一个实验室制取氯气并以氯气为原料进行特定反应的装置.
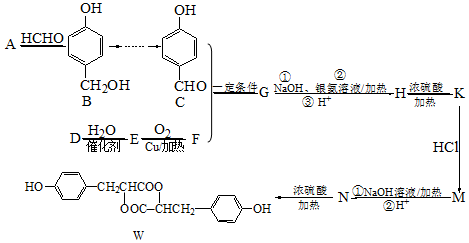
 .
.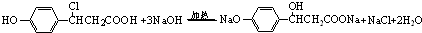 .
.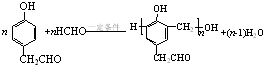 .
.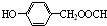 .
.