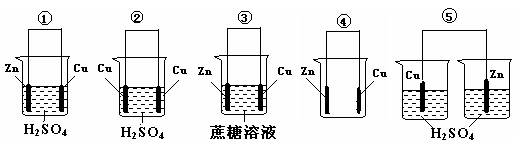
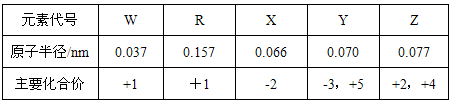
题目内容
1871年,门捷列夫预言:一定存在一种元素,在元素周期表中它紧排在锌的后面,处于铝和铟之间.他将其称为“类铝”,并预测了它的性质.四年后,法国化学家布瓦博德朗发现了它——镓(Ga),并通过实验证实了门捷列夫的预测.当你看到这个资料后,你是否联想到,门捷列夫是怎样如此准确地预测的?对化学元素及其性质的预测需要具备和掌握运用哪些规律和知识?是不是应该是“元素性质之间的一种内在联系”?这种联系是什么?为什么有这种联系?
解析:
|
答案:首先是元素之间在原子结构上存在着一定的联系.经过逐一研究发现,介于铝和铟之间而排在锌后面的这种元素,与铝和铟一样,最外电子层上都有 3个电子,所以半径介于铝和铟之间,因此,它和铝、铟相似,有较强的失电子的能力,能失去3个电子,最高正价该是+3价,形成的同类的化合物的性质也相似;但电子层数比铝多一层,而比铟少一层,所以,它失去电子的能力比铝弱,而比铟容易,同类化合物的相似的性质也界于铝和铟的化合物之间.思路:要对化学元素及其性质能够准确地预测,必须掌握元素之间的内在联系.性质的内在联系,应该是原子结构的内在联系的外在表现.镓在周期表中与铝和铟同为第三主族元素,因此和第三主族元素的性质应该相似,但介于铝和铟之间.其结构特点也应该与铝和铟有相似和递变关系. |

 阅读快车系列答案
阅读快车系列答案
| |||||||||||||||||||||||||||||||
 的中子数为______,该氯原子与
的中子数为______,该氯原子与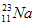 原子形成的化合物的摩尔质量为________,用电子式表示该化合物的形成过程 ______________________。
原子形成的化合物的摩尔质量为________,用电子式表示该化合物的形成过程 ______________________。