题目内容
1871年门捷列夫在发表元素周期表的同时科学地预言了三种新元素的存在,其预言竟然与后人的发现取得了惊人的一致,其预言的依据就是元素周期律理论。元素周期律理论揭示了元素性质呈现周期性变化,其性质包括核外电子排布、原子半径和元素主要化合价等。请你像门捷列夫一样,预测解决以下问题:(1)A元素原子最外层电子数是次外层电子数的3倍,B元素原子次外层原子数是最外层电子数的2倍,则A、B元素( )
A.一定是第2周期元素 B.一定是同一主族元素
C.可能是第2、3周期元素 D.可以相互化合形成化合物
(2)某元素X的核外电子数等于核内中子数,取该元素单质
A.第3周期 B.第2周期 C.第ⅣA族 D.第ⅤA族
(3)根据原子结构理论和元素周期律,请预测原子序数为114的元素(此元素尚未命名,暂用M表示其元素符号)的有关知识。(在周期表中的位置、原子结构、构成氧化物和对应水化物的化学式、放射性等)
解析:(1)因最外层电子不多于8个,A元素的次外层电子只能是2个,故最外层电子是6个,则A为O元素。B元素原子的次外层电子数是最外层电子数的2倍,B可能是Li元素或Si元素。
(2)X + O2![]() XO2
XO2
Mr(X) Mr(X)+32
得Mr(X)=28,X是Si元素。
(3)第7周期的稀有气体元素的原子序数是118,因此114号元素一定位于第7周期内。根据自右向左各族排列的规则,可确定114号元素位于第ⅣA族,应该具有+2、+4两个正化合价,氧化物化学式为MO和MO2,氧化物的水化物的化学式为M(OH)2和M(OH)4 。自87号Fr元素开始的元素都具有放射性,则114号元素也应该具有放射性。
答案:(1)CD (2)AC (3)原子具有114个质子,114个电子,七个电子层,最外层电子数为4。位于第7周期、第ⅣA族,具有+2和+4两个正化合价,元素的金属性较强。单质还原性较强,氧化物化学式为MO和MO2,氧化物的水化物的化学式为M(OH)2和M(OH)4,元素有放射性。

| |||||||||||||||||||||||||||||||
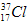 的中子数为______,该氯原子与
的中子数为______,该氯原子与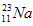 原子形成的化合物的摩尔质量为________,用电子式表示该化合物的形成过程 ______________________。
原子形成的化合物的摩尔质量为________,用电子式表示该化合物的形成过程 ______________________。