题目内容
城市使用的燃料,现大多为煤气、液化石油气.煤气的主要成分是CO和H2的混合气体,它有煤炭与水蒸气在高温下反应制得,故又称水煤气.试回答:
(1)写出制取水煤气的主要化学方式
(2)设液化石油气的主要成分为丁烷(C4H10),其充分燃烧后产物为C02和H2O,试比较完全燃烧等质量的C4H10及CO所需的氧气的质量比
(1)写出制取水煤气的主要化学方式
H2O+C
CO+H2
| ||
H2O+C
CO+H2
,该反应是
| ||
吸
吸
反应(填吸热、放热).(2)设液化石油气的主要成分为丁烷(C4H10),其充分燃烧后产物为C02和H2O,试比较完全燃烧等质量的C4H10及CO所需的氧气的质量比
6.3:1
6.3:1
(结果保留1位小数).分析:(1)根据题目信息来书写,该反应是吸热反应;
(2)写出各自的化学方程式,计算求出氧气的质量.
(2)写出各自的化学方程式,计算求出氧气的质量.
解答:解:(1)根据信息:将煤(主要成分是碳)在高温条件下与水蒸气反应,制得水煤气(CO和H2的混合气体),可知化学反应式是:H2O+C
CO+H2,该反应是吸热反应,
故答案为:H2O+C
CO+H2;吸热;
(2)2C4H10+13O2
8CO2+10H2O
116 416
m
2CO+O2
2CO2
56 32
m
则燃烧等质量的C4H10及CO所需的氧气的质量比为
:
=6.3:1,故答案为:6.3:1.
| ||
故答案为:H2O+C
| ||
(2)2C4H10+13O2
| 点燃 |
116 416
m
| 416m |
| 116 |
2CO+O2
| 点燃 |
56 32
m
| 32m |
| 56 |
则燃烧等质量的C4H10及CO所需的氧气的质量比为
| 416m |
| 116 |
| 32m |
| 56 |
点评:本题主要考查了化学方程式的书写与计算,难度不大,根据所学知识即可完成.

练习册系列答案
相关题目
(8分)城市使用的燃料,现大多用煤气、液化石油气。煤气的主要成分是CO和H2的混合气体,它由煤炭和水蒸气反应制得,故又称水煤气。
(1)试写出制取水煤气的主要化学方程式____________________________.
(2)液化石油气的主要成分是丙烷,丙烷燃烧的热化学方程式为
C3H8(g) +5O2(g)
== 3CO2(g) + 4H2O(l);△H=–2220.0 kJ·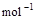 ,
,
又知CO气体燃烧的热化学方程式为:
CO(g) +1/2O2(g) == CO2(g) ;△H=–282.57kJ·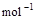 ,
,
试比较同质量的C3H8和CO燃烧,产生的热量比值约为_________:1。
(3)已知氢气燃烧的热化学方程式为2H2(g)
+ O2(g) == 2H2O(l);△H=–571.6 kJ·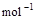 ,试比较同质量的H2和C3H8燃烧,产生的热量比值约为____________:1。
,试比较同质量的H2和C3H8燃烧,产生的热量比值约为____________:1。
(4)氢气是未来的能源,除来源丰富之外,还具有的优点是____________________
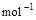 ,试比较同质量的H2和C3H8燃烧,产生的热量比值约为____________:1。
,试比较同质量的H2和C3H8燃烧,产生的热量比值约为____________:1。 ,
,