题目内容
【题目】如图是自来水表的常见安装方式.下列有关说法不正确的是( ) 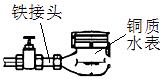
A.发生腐蚀过程中,电子从接头流向水表
B.腐蚀时,铁接头发生的是还原反应
C.腐蚀时铜质水表发生的电极反应为:2H2O+O2+4e﹣═4OH﹣
D.腐蚀过程还涉及到反应:4Fe(OH)2+2H2O+O2═4Fe(OH)3
【答案】B
【解析】解:A、构成原电池,铁活泼为负极,保护铜,电子由铁流向铜即接头流向水表,故A正确;
B、构成原电池,铁活泼为负极发生氧化反应,故B错误;
C、水表发生了吸氧腐蚀,氧气在水表的表面得电子,电极反应式为:2H2O+O2+4e﹣=4OH﹣,故C正确;
D、负极放电产生的亚铁离子与正极产生氢氧根离子结合成氢氧化亚铁,氢氧化亚铁被空气中的氧气氧化生成氢氧化铁,所以腐蚀过程还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3,故D正确;
故选B.
【考点精析】利用金属的电化学腐蚀与防护对题目进行判断即可得到答案,需要熟知金属的保护:涂保护层;保持干燥;改变金属的内部结构,使其稳定;牺牲阳极的阴极保护法即用一种更为活泼的金属与要保护的金属构成原电池;外加电源法.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目