题目内容
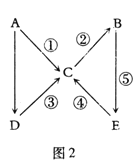
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:
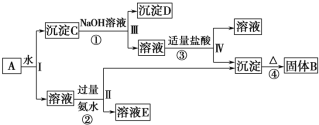
据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是__。
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式
固体B__;沉淀C__;沉淀D__;溶液E___。
(3)写出①、②、③、④四个反应的化学方程式或离子方程式
①__;
②___;
③___;
④__。
【答案】过滤 Al2O3 Al2O3、Fe2O3 Fe2O3 K2SO4、(NH4)2SO4 Al2O3+2NaOH=2NaAlO2+H2O Al3++3NH3·H2O=Al(OH)3↓+3NH4+ NaAlO2+HCl+H2O=Al(OH)3↓+NaCl 2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
【解析】
KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀C为Al2O3和Fe2O3;由转化关系图可知,向沉淀C中加NaOH溶液,Fe2O3不反应,沉淀D为Fe2O3,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,Al(OH)3受热分解生成固体B为Al2O3;向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中E为K2SO4、(NH4)2SO4,经过蒸发、结晶,得到K2SO4和(NH4)2SO4,然后结合物质的性质及化学用语来解答。
(1)溶液和沉淀的分离利用过滤;
(2)由上述分析可知B为Al2O3,C为Al2O3、Fe2O3,D为Fe2O3溶液E为K2SO4、(NH4)2SO4;
(3)反应①为Al2O3+2NaOH=2NaAlO2+H2O;
反应②为Al3++3NH3H2O=Al(OH)3↓+3NH4+;
反应③为NaAlO2+HCl+H2O=Al(OH)3↓+NaCl;
反应④为2Al(OH)3![]() Al2O3+3H2O。
Al2O3+3H2O。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
方法c | 电解法,反应为2Cu + H2O |
方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
(1)已知:①2Cu(s)+![]() O2(g)=Cu2O(s)△H = -169kJ·mol-1,②C(s)+
O2(g)=Cu2O(s)△H = -169kJ·mol-1,②C(s)+![]() O2(g)=CO(g)△H = -110.5kJ·mol-1,③ Cu(s)+
O2(g)=CO(g)△H = -110.5kJ·mol-1,③ Cu(s)+![]() O2(g)=CuO(s)△H = -157kJ·mol-1,则方法a发生的热化学方程式是:____________。
O2(g)=CuO(s)△H = -157kJ·mol-1,则方法a发生的热化学方程式是:____________。
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:
该离子交换膜为____离子交换膜(填“阴”或“阳”),该电池的阳极反应式为_____,钛极附近的pH值________(填“增大”“减小”或“不变”)。

(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为________。
(4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验:![]() △H>0。水蒸气的浓度随时间t变化如下表所示:
△H>0。水蒸气的浓度随时间t变化如下表所示:
序号 | 0 | 10 | 20 | 30 | 40 | 50 | |
① | p>T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
①对比实验的温度:T2_________T1(填“﹥”“﹤”或“﹦”),能否通过对比实验①③到达平衡所需时间长短判断:_________(填 “能”或“否”)。
②实验①前20 min的平均反应速率 v(O2)=_________
③催化剂的催化效率:实验①___________实验②(填“﹥”或“﹤”)。