题目内容
|
在10 mL 0.01 mol·L-1的纯碱溶液中不断搅拌并逐滴加入1.2 mL 0.05 mol·L-1盐酸,完全反应后,在标准状况下生成二氧化碳气体的体积为( ). | |
| [ ] | |
A. |
1.344 mL |
B. |
2.240 mL |
C. |
0.672 mL |
D. |
0 mL |
答案:D
解析:
解析:
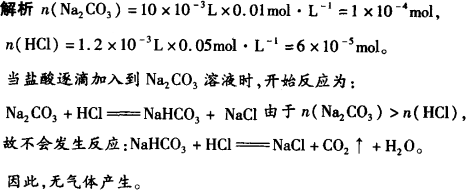

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
|
在10 mL 0.01 mol·L-1的纯碱溶液中,不断搅拌并逐滴加入1.2 mL 0.05 mol·L-1 HCl,完全反应后在标准状况下生成二氧化碳的体积为 | |
A. |
1.344 mL |
B. |
2.240 mL |
C. |
0.672 mL |
D. |
0 mL |

 H++OH- KW=10-14 CH3COOH
H++OH- KW=10-14 CH3COOH