题目内容
设NA为阿伏加德罗常数的值。下列说法正确的是
A.在反应5NH4NO3  2HNO3+4N2↑+9H2O中,每生成4 mol N2,转移电子数为10NA 2HNO3+4N2↑+9H2O中,每生成4 mol N2,转移电子数为10NA |
| B.12.5 mL 16 mol·L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
| C.标准状况下,1.12L的SO3所含的原子数约为0.2NA |
| D.标准状况下,2.2gCO2气体中所含分子数为0.05NA |
D
解析试题分析:A、反应5NH4NO3 2HNO3+4N2↑+9H2O中,根据价态归中规律,每生成4 mol N2,转移电子数为15NA,错误;B、12.5 mL 16 mol·L-1浓硫酸与足量铜反应,随着反应的进行硫酸的浓度逐渐变稀,稀硫酸和铜不反应,转移电子数小于0.2NA,错误;C、标准状况下, SO3不是气体,错误;D、标准状况下,2.2gCO2气体中所含分子数为0.05NA,正确。
2HNO3+4N2↑+9H2O中,根据价态归中规律,每生成4 mol N2,转移电子数为15NA,错误;B、12.5 mL 16 mol·L-1浓硫酸与足量铜反应,随着反应的进行硫酸的浓度逐渐变稀,稀硫酸和铜不反应,转移电子数小于0.2NA,错误;C、标准状况下, SO3不是气体,错误;D、标准状况下,2.2gCO2气体中所含分子数为0.05NA,正确。
考点:考查阿伏加德罗常数。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案NA表示阿伏加德罗常数,下列说法中正确的是
| A.2.4g镁与足量的盐酸反应,电子转移数目为0.1NA |
| B.0.5mol/L的Na2SO4的溶液中含NA个Na+ |
| C.1molNa2O2固体中含2NA个阴离子 |
| D.1molCH5+离子所含电子数为10NA |
下列溶液中Cl-的物质的量浓度和Cl-的物质的量与50 mL 1 mol·L-1的AlCl3溶液中Cl-物质的量浓度和Cl-的物质的量都相等的是
| A.75 mL 2 mol·L-1 的NH4Cl | B.150 mL 1 mol·L-1 的NaCl |
| C.50 mL 1.5 mol·L-1 的CaCl2 | D.50 mL 3 mol·L-1 的KClO3 |
下列各组中的两种气体的分子数一定相同的是
| A.质量相等但密度不等的N2和C2H4 | B.体积相同的N2和C2H4 |
| C.等温、等体积的N2和O2 | D.等压、等体积N2和CO2 |
将3.52克CO2和SO2混合气体通入一定量的NaOH溶液中,气体全部与NaOH反应生成盐,将反应后的溶液减压低温蒸干后得到不含结晶水的固体,固体的质量可能为
| A.8.48克 | B.7.48克 | C.5.72克 | D.5.22克 |
如图所示,常温常压下气体X(见选项)与O2等物质的量混合后充满圆底烧瓶,挤压胶头滴管并打开止水夹,可观察到烧杯中的水沿导管进入烧瓶。长时间充分反应后,烧瓶中所得溶液的物质的量浓度最小的是(假设溶质不向烧瓶外扩散)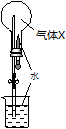
| A.NH3 | B.HCl | C.SO2 | D.NO2(假设不含N2O4) |
将9.0 g铜和铁的混合物投入100mL稀硝酸中,充分反应后得到标准状况下1.12L NO,剩余4.8 g金属;继续加入100mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是( )
| A.原混合物中铜和铁各0.075mol |
| B.稀硝酸的物质的量浓度为0.5mol·L-1 |
| C.第一次剩余4.8g金属为铜和铁 |
| D.再加入上述100mL稀硝酸,又得到标准状况下1.12L NO |
在标准状况下,将某X气体V L溶于水中,得到12mol·L-1的溶液500mL,则气体的体积V是( )
| A.134.4L | B.67.2L | C.44.8L | D.537.6L |
在体积相同的两个密闭容器中分别充满C2H4、C3H6气体,当这两个容器内温度和气体密度相等时,下列说法正确的是
| A.两种气体的压强相等 | B.C2H4比C3H6的质量小 |
| C.两种气体的分子数目相等 | D.两种气体所含的原子数目相等 |