题目内容
以海水中常见物质A为原料可以发展很多种工业,下图中包含了中学课本中介绍的几种基本工业生产,请根据各物质之间的转化关系回答下列问题:
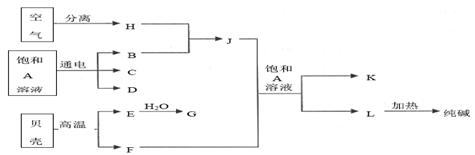
(1)C和D、C和G反应都可以制取消毒剂。C和G反应制取的消毒剂中有效成分的化学式为______________________。C和D反应的化学方程式____________________。
(2)将F和J通入A的饱和溶液中,反应的化学方程式为:_________________________
向A的饱和溶液中通入F和J时,应先通入_______(填化学式)至饱和,再通入另一种气体。
(3)将铝片和镁片用导线相连插入D的稀溶液中构成原电池,写出负极的电极反应式____________________________。
(4)已知:

样品中NaCl的质量分数的数学表达式为__________________________
(5)下列说法正确的是
①NO、CO、CO2均为酸性氧化物
②CO2的大量排放会导致温室效应,所以应尽量选用公共交通,提倡低碳 出行
出行
③汽车尾气中的氮氧化物主要是空气中的氮气与氧气在高温条件下生成的
(6)实验室可利用NaOH溶液吸收CO2,标准状况下2.24LCO2气体被1.5 L 0.1 mol/L NaOH溶液全部吸收(不考虑CO2溶于水),生成Na2CO3的物质的量为 mol。

(1)C和D、C和G反应都可以制取消毒剂。C和G反应制取的消毒剂中有效成分的化学式为______________________。C和D反应的化学方程式____________________。
(2)将F和J通入A的饱和溶液中,反应的化学方程式为:_________________________
向A的饱和溶液中通入F和J时,应先通入_______(填化学式)至饱和,再通入另一种气体。
(3)将铝片和镁片用导线相连插入D的稀溶液中构成原电池,写出负极的电极反应式____________________________。
(4)已知:

样品中NaCl的质量分数的数学表达式为__________________________
(5)下列说法正确的是
①NO、CO、CO2均为酸性氧化物
②CO2的大量排放会导致温室效应,所以应尽量选用公共交通,提倡低碳
 出行
出行③汽车尾气中的氮氧化物主要是空气中的氮气与氧气在高温条件下生成的
(6)实验室可利用NaOH溶液吸收CO2,标准状况下2.24LCO2气体被1.5 L 0.1 mol/L NaOH溶液全部吸收(不考虑CO2溶于水),生成Na2CO3的物质的量为 mol。
(1)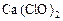 (1分) Cl2+2NaOH=NaCl+NaClO+H2O(2分)
(1分) Cl2+2NaOH=NaCl+NaClO+H2O(2分)
(2)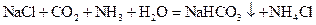 (2分)
(2分)
NH3(1分)
(3)Al + 4OH - -3e - =AlO2- +2H2O(2分)
(4 )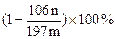 (2分) (5)②③(2分) (6) 0.05(2分)
(2分) (5)②③(2分) (6) 0.05(2分)
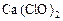 (1分) Cl2+2NaOH=NaCl+NaClO+H2O(2分)
(1分) Cl2+2NaOH=NaCl+NaClO+H2O(2分)(2)
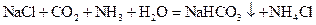 (2分)
(2分)NH3(1分)
(3)Al + 4OH - -3e - =AlO2- +2H2O(2分)
(4 )
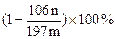 (2分) (5)②③(2分) (6) 0.05(2分)
(2分) (5)②③(2分) (6) 0.05(2分)略

练习册系列答案
相关题目
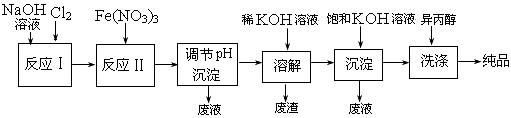
 可用于补钙抗过敏等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2 ·2H2O的质量分数为97.3—103.0%),工艺流程为:
可用于补钙抗过敏等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2 ·2H2O的质量分数为97.3—103.0%),工艺流程为: 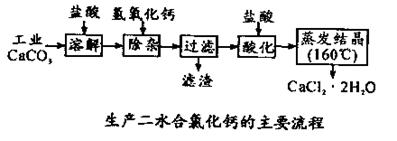

 结晶要保持在160℃: 。
结晶要保持在160℃: 。
 :
:
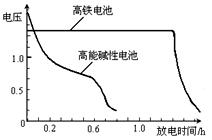
 ,上图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ▲ 、 ▲ 。
,上图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ▲ 、 ▲ 。