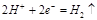题目内容
下列叙述中正确的是
- A.热化学方程式2H2(g)+O2(g)====H2O(l);ΔH=-571.6kJ·mol-1中ΔH表示H2的燃烧热
- B.分子晶体的熔点、沸点随共价键增强而升高
- C.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
- D.阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同
C
A中1 mol H2完全燃烧的反应热表示H2的燃烧热。B中分子晶体的熔沸点与分子间作用力有关,与共价键强弱无关。D项如:简单阴离子的核外电子排布应与本周期稀有气体元素原子的核外电子排布相同。
A中1 mol H2完全燃烧的反应热表示H2的燃烧热。B中分子晶体的熔沸点与分子间作用力有关,与共价键强弱无关。D项如:简单阴离子的核外电子排布应与本周期稀有气体元素原子的核外电子排布相同。

练习册系列答案
相关题目
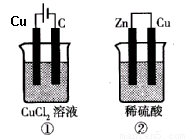
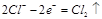 ②中负极
②中负极