题目内容
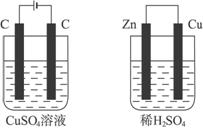
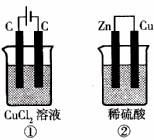
如下图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,则下列叙述中正确的是( )

A.产生气体的体积:①>②
B.溶液的pH变化:①不变 ②增大
C.①和②中铜电极均失电子
D.电极反应式:①中阳极  ②中负极
②中负极 
【答案】
B
【解析】根据装置图可以判断,①是电解池,②是原电池。在电解池中铜和电源的正极相连,是阳极,失去电子,被氧化发生氧化反应。碳棒是阴极,溶液中的铜离子得到电子,被还原而析出铜单质。在原电池中锌比铜活泼,所以锌是负极,失去单质,被氧化发生氧化反应。铜是正极,溶液中的氢离子在正极上得到电子,发生还原反应而产生氢气。硫酸的物质的量是0.02mol,当通过0.02mol电子时,生成氢气0.01mol,即硫酸是过量的。所以正确的答案是B。

练习册系列答案
相关题目