题目内容
8.下列说法正确的是( )| A. | 需加热才能发生的反应一定是吸热反应 | |
| B. | 放热反应都不需要加热就能发生 | |
| C. | 化学反应的过程中一定有物质变化,可以没有能量变化 | |
| D. | 化学反应是放热还是吸热,取决取反应物具有的总能量和生成物具有的总能量的相对大小 |
分析 A.反应条件与吸热、放热反应无关;
B.放热反应可能需要加热;
C.化学反应中一定有物质、能量变化;
D.反应物具有的总能量和生成物具有的总能量的相对大小决定反应吸热还是放热.
解答 解:A.反应条件与吸热、放热反应无关,则加热发生的反应可能为吸热反应,如C与二氧化碳反应,可能为放热反应,如C与氧气反应,故A错误;
B.放热反应可能需要加热,如Fe与氯气反应为放热反应,故B错误;
C.化学反应中一定有物质、能量变化,则化学反应的过程中一定有物质变化,可能吸收或放出能量,故C错误;
D.反应物具有的总能量和生成物具有的总能量的相对大小决定反应吸热还是放热,若反应物总能量大,为放热反应,反之为吸热反应,故D正确;
故选D.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、反应条件与反应能量变化无关为解答的关键,侧重分析与应用能力的考查,注意选项A为易错点,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.某化学兴趣小组制备硫化亚铁并探究其自燃性质.
实验I 在石棉网上把研细的硫粉和铁粉按一定比例混合均匀,用灼热的玻璃棒触及混合物,当混合物呈红热状态时,移开玻璃棒,得到黑色FeS.
(1)玻璃棒的作用是加热引发铁与硫发生反应.
(2)常温下,该实验制得的硫化亚铁不能(填“能”或“不能”)自燃.
实验II 将H2S气体长时间通入硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中进行硫化,制备硫化亚铁.装置示意图如下.
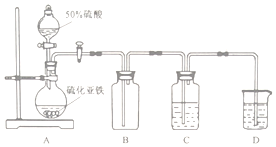
(3)B装置的作用是缓冲瓶(或安全瓶).
(4)C中反应生成硫化亚铁的离子方程式为H2S+Fe2+=FeS↓+2H+
(5)C中的固液混合物经过滤、洗涤、干燥得到产品.检验过滤所得固体物质是否洗涤干净的方法是取少量洗涤液,滴加氯化钡溶液,茗无白色浑浊,则已经洗净.
(6)产品分析结果表:
①表中x=60.50
②总铁质世分数大于亚铁质量分数,原因是产品中含有三价铁杂质
(7)制得的硫化亚铁在常温下能发生缓慢氧化而自燃,写出该过程的化学方程式:4FeS+7O2=2Fe2O3+4SO2(写一个).
实验I 在石棉网上把研细的硫粉和铁粉按一定比例混合均匀,用灼热的玻璃棒触及混合物,当混合物呈红热状态时,移开玻璃棒,得到黑色FeS.
(1)玻璃棒的作用是加热引发铁与硫发生反应.
(2)常温下,该实验制得的硫化亚铁不能(填“能”或“不能”)自燃.
实验II 将H2S气体长时间通入硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中进行硫化,制备硫化亚铁.装置示意图如下.

(3)B装置的作用是缓冲瓶(或安全瓶).
(4)C中反应生成硫化亚铁的离子方程式为H2S+Fe2+=FeS↓+2H+
(5)C中的固液混合物经过滤、洗涤、干燥得到产品.检验过滤所得固体物质是否洗涤干净的方法是取少量洗涤液,滴加氯化钡溶液,茗无白色浑浊,则已经洗净.
(6)产品分析结果表:
| 硫质量分数/% | 总铁质量分数/% | 亚铁质量分数/% | 硫化亚铁质量分数/% |
| 22.00 | 44.60 | 38.50 | x |
②总铁质世分数大于亚铁质量分数,原因是产品中含有三价铁杂质
(7)制得的硫化亚铁在常温下能发生缓慢氧化而自燃,写出该过程的化学方程式:4FeS+7O2=2Fe2O3+4SO2(写一个).
19.有A、B两种气体,在相同温度、相同压强下,当它们的质量比为2:1时,其体积比为3:2,则A、B的摩尔质量之比为( )
| A. | 1:2 | B. | 2:1 | C. | 2:3 | D. | 4:3 |
16.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在标准情况下,22.4L CH4与18gH2O含有的分子数均为NA | |
| B. | 0.1mol•L-1的FeCl3溶液中含有Fe3+的数目小于0.1NA | |
| C. | 0.1molNa2O2中含有的阴离子的数目为0.2NA | |
| D. | 0.1mol铁粉与足量水蒸气在高温下反应,生成的H2分子数为0.15NA |
13.化学是一门实用的中心学科,我们的生活离不开化学,下列有关说法中不正确的是( )
| A. | 甘蔗渣可经化学反应制得酒精 | |
| B. | 棉花、蚕丝和人造丝的主要成分都是纤维素 | |
| C. | 厨房里洗涤油污,常用碱性洗涤剂,因为植物油会在碱性溶液中水解 | |
| D. | 不能用米汤检验食用碘盐中的碘酸钾 |
20.下列各溶液中,有关成分的物质的量浓度关系正确的是( )
| A. | 10 mL 0.5 mol•L-1 CH3COONa 溶液与 6 mL1 mol•L-1 盐酸混合:c(Cl-)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 0.1 mol•L-1pH 为 4 的 NaHB 溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | pH 相等的(NH4)2SO4、(NH4)2Fe(SO4)2和 NH4Cl 溶液中:c[(NH4)2SO4]>c[(NH4)2Fe(SO4)2]>c(NH4Cl) |
17.两种元素X、Y,其原子核外电子层数分别为a、b,最外层电子数分别为m、n,下列说法不正确的是( )
| A. | 若8>m>3,则X必定为P区元素 | |
| B. | 若Y的气态氢化物化学式为YHn,且b<4,则该氢化物一定为极性分子 | |
| C. | 若a=b=3,8>m>n>b,则元素非金属性:X>Y | |
| D. | 若a<b<m=n=4,则晶体类型相同时,其单质熔点:Y<X |
1.NA为阿佛加德罗常数,下列叙述不正确的是( )
| A. | 标准状况下,22.4 L的CH2Cl2中所含质子数为42 NA | |
| B. | 2 mol SO2和1 mol O2在一定条件下充分反应后,所得混合气体的分子数大于2NA | |
| C. | 12 g石墨晶体中含有的碳碳键数目为1.5 NA | |
| D. | 分子数为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA |