题目内容
下列各组离子在指定的溶液中一定能大量共存的是( )
| A.无色溶液:K+、Al3+、NO3—、AlO2— |
| B.pH=12的溶液:K+、Cl-、SO32—、SiO32— |
| C.含0.1 mol·L-1 NO3—的溶液:H+、Fe2+、Cl-、SO42— |
| D.由水电离产生的c(H+)=1×10-12 mol·L-1的溶液:Na+、NH4+、SO42—、HCO3— |
B
解析

练习册系列答案
相关题目
下列分子或离子在指定的分散系中能大量共存的一组是( )
| A.银氨溶液: Na+、K+、NO3-、NH3·H2O |
| B.空气: C2H2、CO2、SO2、NO |
| C.氢氧化铁胶体: H+、K+、S2-、Br— |
| D.高锰酸钾溶液: H+、Na+、SO42-、葡萄糖分子 |
在下列溶液中,能大量共存的离子组是( )
A.能使pH试纸显蓝色的溶液中: |
B.常温下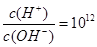 的溶液中: 的溶液中:  |
C.含有大量Al3+的溶液中: |
| D.常温下pH为7的溶液中: K+、Fe3+ 、Cl-、SO42- |
下列离子方程式中,正确的是( )
| A.将Na2O2固体投入H218O中:2H218O+2Na2O2 = 4OH-+4Na++18O2↑ |
| B.1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积互相均匀混合:2AlO2- + 5 H+=Al(OH)3↓+Al3++H2O |
| C.碳酸氢钠溶液与少量氢氧化钡溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| D.硅酸钠溶液与醋酸溶液混合:SiO32-+ 2H+ = H2SiO3↓ |
某澄清溶液中可能含有下列离子中的几种:Na+、NH4+、Fe2+、Fe3+、Ba2+、SO42-、HCO3-、Cl-。对其进行如下实验:
①用玻璃棒蘸取该溶液滴在pH试纸上,试纸显红色;
②另取少量溶液加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀;
③取②中上层清液加入酸化的硝酸银溶液,也生成白色沉淀。
下列关于该溶液的说法中正确的是( )
| A.该溶液中一定不存在Ba2+和HCO3- |
| B.取③中滤液加入KSCN,溶液显血红色,则原溶液中一定有Fe3+ |
| C.该溶液中一定存在SO42-和Cl- |
| D.另取该溶液加入少量稀NaOH溶液,微热,试管口的湿润红色石蕊试纸不变蓝,则原溶液中一定不存在NH4+ |
下列反应的离子方程式书写正确的是( )
A.在澄清石灰水中加入少量小苏打:Ca2++OH-+HC  CaCO3↓+H2O CaCO3↓+H2O |
B.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O 2C6H5OH+C 2C6H5OH+C |
C.将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O S S +2HClO +2HClO |
D.将标准状况下112 mL氯气通入10 mL浓度为1 mol·L-1的溴化亚铁溶液中:2Fe2++4Br-+3Cl2 2Fe3++6Cl-+2Br2 2Fe3++6Cl-+2Br2 |
NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2的反应方程是:MnO4—+NO2—+  Mn2++NO3—+H2O(未配平)。下列叙述中正确的是( )
Mn2++NO3—+H2O(未配平)。下列叙述中正确的是( )
| A.该反应中NO2—被还原 |
| B.反应过程中溶液的pH减小 |
| C.生成1 mol NaNO3需消耗0.4 mol KMnO4 |
| D.中的粒子是OH- |
下列关于常温下电解质溶液的叙述中,正确的是( )
| A.碳酸氢铵溶液和足量氢氧化钠溶液混合的离子反应:HCO3-+OH-=CO32-+H2O |
| B.等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+c(NH4+)=c(Cl-)+c(OH-) |
| C.等物质的量浓度的NH4Cl溶液和NH3·H2O溶液,溶液中c(NH4+)前者小于后者 |
| D.25℃时,pH=8的0.1 mol·L-1NaX溶液中由水电离出的c(OH-)=1×10-8 mol·L-1 |
下列离子方程式均正确的是( )
A.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+ Cu2++2Fe2+ Cu2++2Fe2+ |
B.铜与浓硝酸反应:Cu+N +2H+ +2H+ Cu2++NO2↑+H2O Cu2++NO2↑+H2O |
C.向NaAlO2溶液中通入过量CO2:2Al +CO2+3H2O +CO2+3H2O 2Al(OH)3↓+C 2Al(OH)3↓+C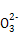 |
D.NaHCO3的水解:HC +H2O +H2O H3O++C H3O++C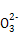 |